Зміст для цієї статті:
1. Розвиток амінокислот
2. Структурні властивості
3. Хімічний склад
4. Класифікація
5. Синтез
6. Фізико -хімічні властивості
7. Токсичність
8. Антимікробна активність
9. Реологічні властивості
10. Застосування в косметичній галузі
11. Застосування в повсякденній косметиці
Поверхнево -активні речовини амінокислот (AAS)є класом поверхнево -активних речовин, що утворюються шляхом поєднання гідрофобних груп з однією або декількома амінокислотами. У цьому випадку амінокислоти можуть бути синтетичними або отримані з гідролізатів білка або подібних відновлюваних джерел. У цьому документі висвітлює деталі більшості доступних синтетичних маршрутів для АА та вплив різних маршрутів на фізико -хімічні властивості кінцевих продуктів, включаючи розчинність, стабільність дисперсії, токсичність та біодеградність. Як клас поверхнево -активних речовин у збільшенні попиту, універсальність АА завдяки їх змінній структурі пропонує велику кількість комерційних можливостей.
Зважаючи на те, що поверхнево -активні речовини широко використовуються в миючих засобах, емульгаторах, інгібіторах корозії, відновлення третинної нафти та фармацевтичних препаратів, дослідники ніколи не перестали звертати увагу на ПАР.
Поверхнево -активні речовини - це найбільш репрезентативні хімічні продукти, які щодня вживаються у великих кількостях у всьому світі і негативно вплинули на водне середовище.Дослідження показали, що широке використання традиційних ПАР може негативно впливати на навколишнє середовище.
Сьогодні нетоксичність, біологічна розкладання та біосумісність майже настільки ж важливі для споживачів, як і корисність та продуктивність ПАР.
Біосуртанти - це екологічно чисті стійкі поверхнево -активні речовини, які, природно, синтезуються мікроорганізмами, такими як бактерії, гриби та дріжджі, або виділяються позаклітинно.Таким чином, біосирфактивні речовини також можна готувати за допомогою молекулярної конструкції для імітації природних амфіфільних структур, таких як фосфоліпіди, алкілглікозиди та ацил -амінокислоти.
Поверхнево -активні речовини амінокислот (AAS)є одним із типових поверхнево -активних речовин, що зазвичай виробляються з сировини тварин або сільського господарства. За останні два десятиліття АА викликало великий інтерес з боку вчених як нових поверхнево-активних речовин, не лише тому, що вони можуть бути синтезовані від відновлюваних ресурсів, а й тому, що АА легко розкладається і нешкідливі побічні продукти, що робить їх безпечнішими для навколишнього середовища.
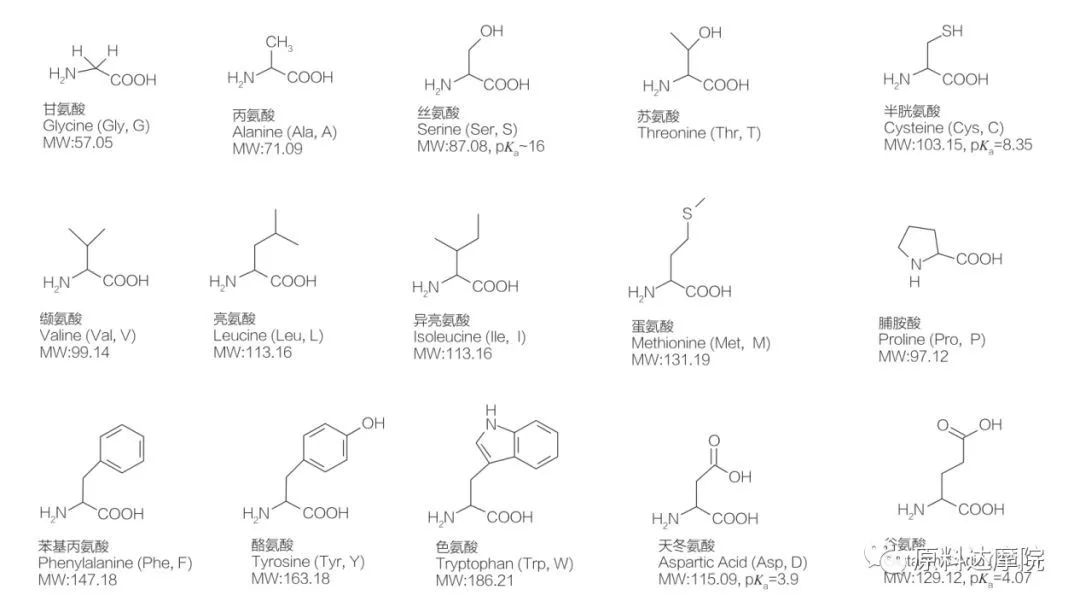
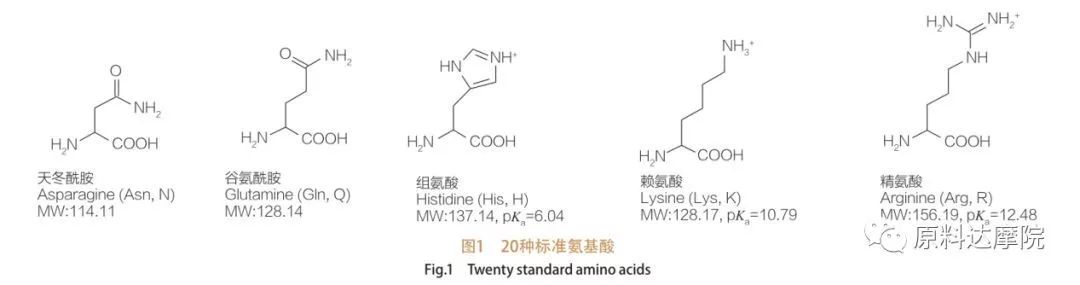
AAS можна визначити як клас поверхнево-активних речовин, що складаються з амінокислот, що містять амінокислотні групи (HO 2 C-CHR-NH 2) або амінокислотних залишків (HO 2 C-CHR-NH-). 2 функціональні області амінокислот дозволяють виводити найрізноманітніші поверхнево -активні речовини. Всього, як відомо, існує 20 стандартних протеїногенних амінокислот, що існують у природі і відповідають за всі фізіологічні реакції в рістах та життєвій діяльності. Вони відрізняються один від одного лише за залишком R (мал. 1, ПК А - негативний логарифм константи дисоціації кислоти). Деякі-неполярні та гідрофобні, деякі-полярні та гідрофільні, деякі-основні, а деякі-кислі.
Оскільки амінокислоти є відновлюваними сполуками, поверхнево -активні речовини, синтезовані з амінокислот, також мають високий потенціал, щоб стати стійкими та екологічно чистими. Проста і природна структура, низька токсичність та швидка біологічна розкладання часто роблять їх чудовими до звичайних поверхнево -активних речовин. Використовуючи відновлювану сировину (наприклад, амінокислоти та рослинні олії), AAS може вироблятися різними біотехнологічними маршрутами та хімічними шляхами.
На початку 20 століття вперше було виявлено, що амінокислоти були використані як субстрати для синтезу ПАР.AAS в основному використовувались як консерванти у фармацевтичних та косметичних рецептурах.Крім того, було виявлено, що AAS є біологічно активним проти різних бактерій, що викликають захворювання, пухлин та вірусів. У 1988 році наявність недорогих AAS викликала науковий інтерес до поверхневої активності. Сьогодні, з розвитком біотехнології, деякі амінокислоти також можуть бути синтезовані комерційно у великих масштабах за дріжджами, що опосередковано доводить, що виробництво AAS є більш екологічним.
01 Розвиток амінокислот
Ще на початку 19 століття, коли вперше були виявлені амінокислоти, що зустрічаються, їх структури, як прогнозували, є надзвичайно цінними - придатною для сировини для приготування амфіфілів. У першому дослідженні синтезу AAS було повідомлено Бонді в 1909 році.
У цьому дослідженні N-ацилгліцин та N-ацилаланін були введені як гідрофільні групи для ПАР. Подальша робота передбачала синтез ліпоамінокислот (AAS) з використанням гліцину та аланіну, та Hentrich et al. опублікував серію висновків,Включаючи перше застосування патенту, щодо використання солей ацил -саркозинату та ацил аспартату як поверхнево -активних речовин у виробах з очищення побуту (наприклад, шампуні, миючі засоби та зубні пасти).Згодом багато дослідників досліджували синтез та фізико -хімічні властивості ацил -амінокислот. На сьогоднішній день було опубліковано велику кількість літератури про синтез, властивості, промислові програми та біодеградність АА.
02 Структурні властивості
Неполярні гідрофобні жирні кислоти АА можуть змінюватись за структурою, довжиною ланцюга та кількістю.Структурна різноманітність та висока поверхнева активність АА пояснюють їх широке композиційне різноманіття та фізико -хімічні та біологічні властивості. Головні групи АА складаються з амінокислот або пептидів. Відмінності в головних групах визначають адсорбцію, агрегацію та біологічну активність цих ПАР. Потім функціональні групи в головній групі визначають тип АА, включаючи катіонний, аніонний, неіонний та амфотеричний. Поєднання гідрофільних амінокислот та гідрофобних довгих ланцюгів утворюють амфіфільну структуру, що робить молекулу високою поверхнею активною. Крім того, наявність асиметричних атомів вуглецю в молекулі допомагає утворювати хіральні молекули.
03 Хімічний склад
Усі пептиди та поліпептиди є продуктами полімеризації цих майже 20 α-бітеїногенних α-амінокислот. Усі 20 α-амінокислот містять функціональну групу карбонової кислоти (-cooh) та амінофункціональну групу (-nh 2), обидва прикріплені до одного тетраедричного атома α-вуглецю. Амінокислоти відрізняються один від одного різними групами R, прикріпленими до α-вуглецю (за винятком ліцину, де група R є воднем.) R-групи можуть відрізнятися за структурою, розміром та зарядом (кислотність, лужність). Ці відмінності також визначають розчинність амінокислот у воді.
Амінокислоти є хіральними (за винятком гліцину) і є оптично активними за своєю природою, оскільки у них є чотири різні заступники, пов'язані з альфа -вуглецем. Амінокислоти мають дві можливі конформації; Вони не перекриваються дзеркальними зображеннями один одного, незважаючи на те, що кількість L-стереоізомерів значно вища. R-група, присутня в деяких амінокислот (фенілаланін, тирозин та триптофан), є арилом, що призводить до максимального поглинання УФ при 280 нм. Кислий α-COOH та основні α-NH 2 в амінокислотах здатні до іонізації, і обидва стереоізомери, які б вони не були, побудують рівновагу іонізації, показану нижче.
R-cooh ↔r-coo-+ Н+
R-NH3+↔R-NH2+ Н+
Як показано в рівновазі іонізації вище, амінокислоти містять щонайменше дві слабокислі групи; Однак карбоксильна група набагато кисліша порівняно з протонованою аміно -групою. РН 7,4, карбоксильна група депротонується, тоді як аміногрупа протонована. Амінокислоти з неіонізованими групами R є електрично нейтральними при цьому рН і утворюють Zwitterion.
04 Класифікація
AAS можна класифікувати за чотирма критеріями, які описані нижче по черзі.
4.1 відповідно до походження
| Згідно з походженням, AAS можна розділити на 2 категорії наступним чином. ① Природна категорія Деякі природні сполуки, що містять амінокислоти, також мають здатність зменшити поверхневе/міжфазне напруження, а деякі навіть перевищують ефективність гліколіпідів. Ці АА також відомі як ліпопептиди. Ліпопептиди - це низькомолекулярні сполуки, які зазвичай виробляються видами Bacillus.
Такі АА далі поділяються на 3 підкласи:ПАРКАКТІН, ІТУРІН І ФЕНГІЦІН.
|
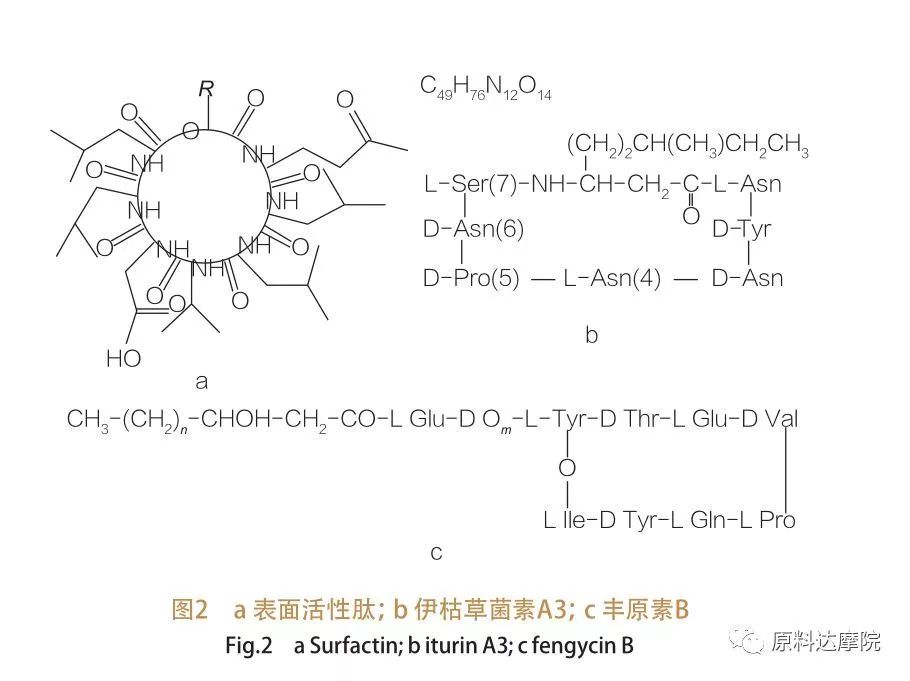
| Сім'я поверхнево-активних пептидів охоплює варіанти гептапептидів різноманітних речовин,Як показано на малюнку 2а, в якому ненасичений ланцюг жирних кислот C12-C16 пов'язаний з пептидом. Поверхнево-активний пептид-це макроциклічний лактон, в якому кільце закрито каталізом між С-кінцем β-гідрокси жирної кислоти та пептидом. У підкласі Ітурину є шість основних варіантів, а саме Ідурину А і С, Мікосубтилін та бациломіцин D, F і L.У всіх випадках гептапептиди пов'язані з ланцюгами C14-C17 β-аміно жирних кислот (ланцюги можуть бути різноманітними). У випадку з екуріцинами аміногрупа в β-положенні може утворювати амідну зв’язок із С-кінцем, таким чином, утворюючи макроциклічну структуру лактаму.
Підклас фенгіцин містить фенгіцин А і В, які також називаються плипастатином, коли Tyr9 конфігурується D.Декапептид пов'язаний з насиченим або ненасиченим β -гідрокси -кислотним ланцюгом C14 -C18. Структурно плипастатин також є макроциклічним лактоном, що містить бічний ланцюг тира в положенні 3 пептидної послідовності і утворює ефірну зв’язок із С-кінцевим залишком, утворюючи таким чином внутрішню структуру кільця (як це стосується багатьох ліпопептидів Pseudomonas).
② Синтетична категорія AAS також може бути синтезований за допомогою будь -якого з кислих, основних та нейтральних амінокислот. Поширені амінокислоти, що використовуються для синтезу АА, - це глутамінова кислота, серин, пролін, аспарагінова кислота, гліцина, аргінін, аланін, лейцинові та білкові гідролізати. Цей підклас поверхнево -активних речовин може бути підготовлений хімічними, ферментативними та хіміоензиматичними методами; Однак для виробництва AAS хімічний синтез є більш економічно здійсненним. Поширені приклади включають N-lauroyl-L-глютамінової кислоти та N-Palmitoyl-L-глютамінової кислоти.
|
4.2 На основі заступників аліфатичного ланцюга
На основі заступників аліфатичного ланцюга поверхнево-активні речовини на основі амінокислот можна розділити на 2 типи.
Відповідно до положення заступника
| ①n-заміщений ААС У N-заміщених сполуках аміногрупа замінюється ліпофільною групою або карбоксильною групою, що призводить до втрати основності. Найпростішим прикладом N-заміщених AAS є N-ацил-амінокислоти, які по суті є аніонними ПАР. N-заміщені АА мають амідну зв'язок, прикріплену між гідрофобними та гідрофільними порціями. Амідна зв'язок має здатність утворювати водневий зв’язок, що полегшує деградацію цього ПАР у кислому середовищі, що робить його біологічним розкладом.
②C-заміщена AAS У сполуках, що заміщуються С, заміщення відбувається в карбоксильній групі (через амідний або ефірний зв’язок). Типові сполуки, що заміщуються C (наприклад, ефірні або аміди), по суті, є катіонними поверхнево-активними речовинами.
③n- та c заміщені АА У цьому типі ПАР, аміно, і карбоксильні групи є гідрофільною частиною. Цей тип по суті є амфотеричною поверхнево -активною речовиною. |
4.3 Відповідно до кількості гідрофобних хвостів
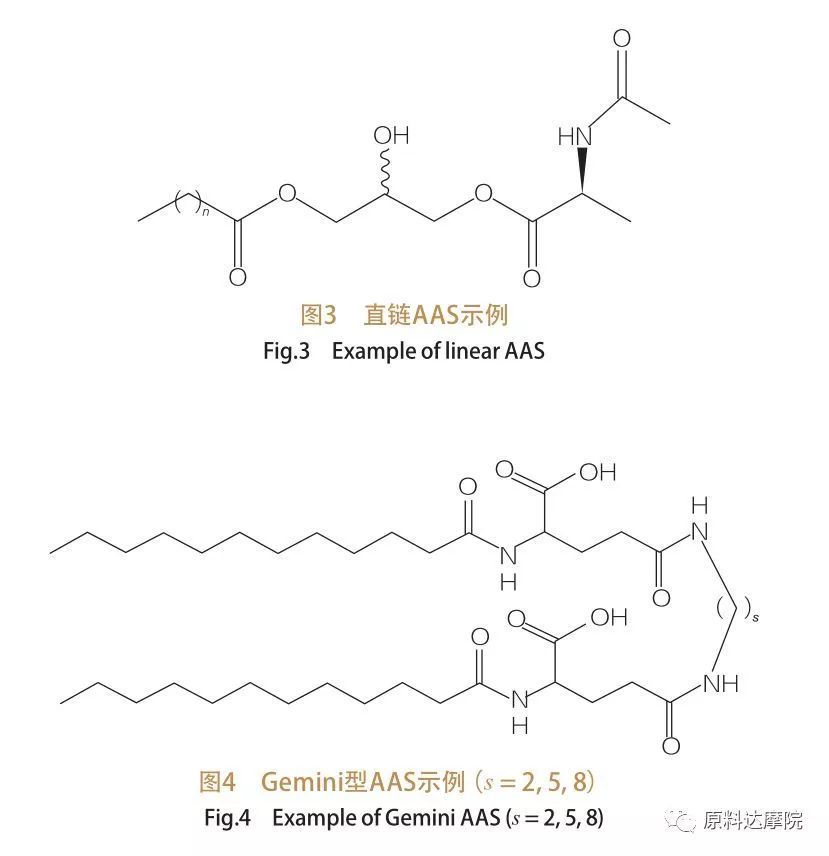
Виходячи з кількості груп голови та гідрофобних хвостів, AAS можна розділити на чотири групи. Пряма ланцюг AAS, Gemini (Dimer) тип AAS, тип гліцероліпідів AAS та біцефалічний амфіфільний (бола) тип AAS. Поверхнево-активні речовини-поверхнево-активні речовини, що складаються з амінокислот лише з одним гідрофобним хвостом (мал. 3). AAS типу Gemini має дві амінокислотні полярні голови та два гідрофобні хвости на молекулу (мал. 4). У такому типі структури два прямих ланцюгів AAS пов'язані між собою спаром, і тому їх також називають димерами. З іншого боку, в гліцероліпідному типі AAS, два гідрофобні хвости прикріплені до тієї ж амінокислотної групи головки. Ці поверхнево-активні речовини можна розглядати як аналоги моногліцеридів, дигліцеридів та фосфоліпідів, в той час як у типу Бола-типу дві амінокислотні голови пов'язані гідрофобним хвостом.
4.4 Відповідно до типу головної групи
①cationic Aas
Голова цього типу ПАР має позитивний заряд. Найдавніший катіонний AAS - це етиловий кокойл аргінат, який є карбоксилатом пірролідону. Унікальні та різноманітні властивості цього ПАР роблять його корисним для дезінфікуючих засобів, антимікробних засобів, антистатичних агентів, кондиціонерів для волосся, а також ніжні на очах і шкірі та легко біологічно розкладаються. Сингар і Мхатре синтезували катіонний АА на основі аргініну та оцінювали їх фізико-хімічні властивості. У цьому дослідженні вони заявляли про високу врожайність продуктів, отриманих за допомогою умов реакцій Шоттена-Бумана. Зі збільшенням довжини алкільного ланцюга та гідрофобності було виявлено, що поверхнева активність ПАР збільшується та критична концентрація міцел (CMC) для зменшення. Ще один - четвертинний ацил -білок, який зазвичай використовується як кондиціонер у засобах по догляду за волоссям.
②anionic Aas
В аніонних поверхневих речовинах група полярної голови ПАР має негативний заряд. Саркозин (CH 3 -NH -ch 2 -cooh, N -метилгліцин), амінокислота, яка зазвичай зустрічається у морських їжаків та морських зірок, хімічно пов'язана з гліцином (NH 2 -CH 2 -cooh), основною амінокислотою, що міститься в клітинах ссавців. -Cooh, хімічно пов'язаний з гліцином, який є основною амінокислотою, що міститься в клітинах ссавців. Лауринова кислота, тетрадеканова кислота, олеїнова кислота та їх галогеніди та ефіри зазвичай використовуються для синтезу поверхнево -активних речовин саркосинату. Саркозинатів за своєю суттю м'які і тому зазвичай використовуються в полосках рота, шампунів, пінопластів для гоління, сонцезахисних кремів, очищувачів шкіри та інших косметичних продуктів.
Інші комерційно доступні аніонні AAS включають AMISOFT CS-22 та Amilitegck-12, які є торговими назвами для натрію N-кокоїл-L-глутамату та гліцинату калію N-кокоїл відповідно. Аміліт зазвичай використовується як піноутворюючий засіб, миючий засіб, розчинник, емульгатор та дисперсанта, і має багато застосувань у косметиці, таких як шампуні, мильні мили, промивання тіла, зубні пасти, очищувачі обличчя, очищення мила, очищувачі лінзів контакту та побутові запаси. Amisoft використовується як м'яке очищувач шкіри та волосся, головним чином у очищувачах обличчя та тіла, блок синтетичних миючих засобів, засобів по догляду за тілом, шампуні та інших засобів по догляду за шкірою.
③zwitterionic або Amphoteric AAS
Амфотеричні поверхнево -активні речовини містять як кислі, так і основні ділянки, і тому можуть змінити свій заряд, змінюючи значення pH. У лужних носіях вони поводяться як аніонні поверхнево -активні речовини, тоді як у кислих умовах вони поводяться як катіонні поверхнево -активні речовини та в нейтральних середовищах, таких як амфотеричні поверхнево -активні речовини. Лаурил лізин (LL) та алкокси (2-гідроксипропіл) аргінін-єдині відомі амфотеричні ПАР на основі амінокислот. LL - продукт конденсації лізину та лауринової кислоти. Завдяки своїй амфотеричній структурі LL нерозчинний майже у всіх типах розчинників, за винятком дуже лужних або кислих розчинників. Як органічний порошок, LL має чудову адгезію до гідрофільних поверхонь і низький коефіцієнт тертя, надаючи цій поверхнево -активній речовині. LL широко використовується в шкірних кремах та кондиціонерах для волосся, а також використовується як мастило.
④Nonionic AAS
Неіонні поверхнево -активні речовини характеризуються полярними головними групами без офіційних зарядів. Вісім нових етоксильованих неіонних ПАР були підготовлені Al-Sabagh et al. з маслянорозчинних α-амінокислот. У цьому процесі L-фенілаланін (LEP) та L-леуцин вперше ентерифікували гексадеканолу з подальшим амідацією пальмітиновою кислотою, щоб отримати два аміди та два ефірів α-амінокислот. Потім аміди та ефіри проходили реакції конденсації з оксидом етилену для приготування трьох похідних фенілаланіну з різною кількістю поліоксиетиленових одиниць (40, 60 та 100). Було виявлено, що ці неіонні АА мають хорошу деталізацію та піноутворюючі властивості.
05 Синтез
5.1 Основний синтетичний маршрут
У AAS гідрофобні групи можуть бути прикріплені до ділянок аміну або карбонової кислоти, або через бічні ланцюги амінокислот. Виходячи з цього, доступні чотири основні синтетичні маршрути, як показано на малюнку 5.
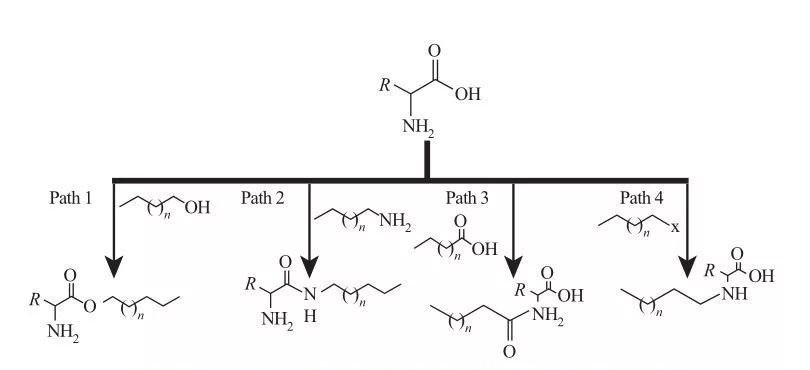
Фіг.5 Основні шляхи синтезу поверхнево-активних речовин на основі амінокислот на основі амінокислот
| Шлях 1. Амфіфільні ефірні аміни виробляються за допомогою реакцій естерифікації, і в цьому випадку синтез поверхнево -активної речовини зазвичай досягається шляхом рефлюксу жирних спиртів та амінокислот у присутності зневоднення та кислого каталізатора. У деяких реакціях сірчана кислота діє як каталізатор, так і зневоднення.
Шлях 2. Активовані амінокислоти реагують з алкіламінами з утворенням амідних зв’язків, що призводить до синтезу амфіфільних амідоамінів.
Шлях 3. Амідо кислоти синтезуються шляхом реагування аміногруп амінокислот з амідо кислотами.
Шлях 4. Довго ланцюгові алкільні амінокислоти синтезували реакцією амінових груп з галоалканами. |
5.2 Успіхи в синтезі та виробництві
5.2.1 Синтез одноланцюгових амінокислот/пептидних поверхневих речовин
N-ACHIL або O-ACHIL амінокислоти або пептиди можуть синтезувати за допомогою ферментного каталізації ацилювання амінових або гідроксильних груп жирними кислотами. Найдавніший звіт про каталізований ліпазе, каталізований ліпазою, амінокислотного аміду або похідних метилового ефіру, використовував Candida Antarctica, причому врожайність становить від 25% до 90% залежно від цільової амінокислоти. Метил етил кетон також використовувався як розчинник у деяких реакціях. Vonderhagen et al. Також описані ліпаза та протеаза, каталізовані N-ациляційні реакції амінокислот, гідролізатів білка та/або їх похідні з використанням суміші води та органічних розчинників (наприклад, диметилформамід/вода) та метилового бутил-кетону.
У перші дні головною проблемою з синтезом ААС, каталізованого ферментами, було низькі врожаї. За даними Valivety et al. Вихід похідних амінокислот N-Tetradecanoyl становив лише 2% -10% навіть після використання різних ліпаз та інкубації при 70 ° С протягом багатьох днів. Montet та ін. Також виникали проблеми щодо низького виходу амінокислот у синтезі N-ацил-лізину з використанням жирних кислот та рослинних олій. Згідно з ними, максимальний вихід продукту становив 19% в умовах без розчинників та використання органічних розчинників. Ця ж проблема виникла в Valivety et al. У синтезі N-CBZ-L-Lysine або N-CBZ-лізин метилового ефіру.
У цьому дослідженні вони стверджували, що вихід 3-O-тетрадеканойл-L-серину становив 80% при використанні N-захищеного N серину як субстрату та новозиму 435 як каталізатор у розплавленому середовищі, що не містить розчинника. Nagao and Kito studied the O-acylation of L-serine, L-homoserine, L-threonine and L-tyrosine (LET) when using lipase The results of the reaction (lipase was obtained by Candida cylindracea and Rhizopus delemar in aqueous buffer medium) and reported that the yields of acylation of L-homoserine and L-serine were somewhat low, while no acylation of L-Треонін і відбулося.
Багато дослідників підтримали використання недорогих та легко доступних підкладок для синтезу економічно вигідних АА. Су та ін. стверджував, що приготування поверхнево-активних речовин на основі пальмової олії найкраще працює з іммобілізованим ліпоензим. Вони зазначили, що врожайність продукції буде кращою, незважаючи на трудомістку реакцію (6 днів). Gerova та ін. досліджували синтез та поверхневу активність хірального N-палмітилу AAS на основі метіоніну, проліну, лейцину, треоніну, фенілаланіну та фенілгліцину в циклічній/рацемічній суміші. Панг і Чу описали синтез мономерів на основі амінокислот та мономерів на основі дикарбонової кислоти в розчині. Серія функціональних та біологічно розкладаних амінокислотних ефірів на основі поліаміду була синтезована реакціями спільної конденсації в розчині.
Кантаузен та Геррейро повідомили про естерифікацію груп карбонової кислоти BoC-Ala-OH та Boc-Asp-OH з аліфатичними спиртами та діолами довголанцюговими, з дихлорметаном як розчинник та агароза 4В (сефароза 4b) як каталізатор. У цьому дослідженні реакція BoC-Ala-OH з жирними спиртами до 16 вуглецю дала хороші врожаї (51%), тоді як для Boc-Asp-O-OH 6 і 12 вуглецю були кращими, відповідний вихід 63% [64]. 99,9%) у доходах від 58%до 76%, які були синтезовані при утворенні амідних зв’язків з різними довголанцюжками алкіламіну або ефірних зв’язків з жирними спиртами CBZ-Arg-OME, де папаїн виступав як каталізатор.
5.2.2 Синтез амінокислот/пептидних поверхнево-активних речовин на основі Gemini
Поверхнево-активні речовини Gemini на основі амінокислот складаються з двох молекул AAS прямого ланцюга, пов’язаних головою до голови один з одним. Існують 2 можливі схеми для хіміоензиматичного синтезу поверхнево-активних речовин на основі амінокислот на основі амінокислот (рисунки 6 та 7). На малюнку 6 2 похідні амінокислот реагують із сполукою як розпірна група, а потім вводиться 2 гідрофобні групи. На малюнку 7 2 структури прямого ланцюга безпосередньо пов'язані між собою біфункціональною розпірною групою.
Найдавніший розвиток ферментів, каталізованого синтезу ліпоамінокислів Близнюків, піонерував валіветів та ін. Yoshimura та ін. досліджували синтез, адсорбцію та агрегацію поверхнево-активної речовини Gemini на основі амінокислот на основі цистину та н-алкильного броміду. Синтезовані поверхнево -активні речовини порівнювали з відповідними мономерними ПАР. Фаустіно та ін. Охарактеризує синтез аніонної мономерної AAS на основі аніонної сечовини на основі L-цистину, D-цистину, DL-цистину, L-цистеїну, L-метіоніну та L-сульфоаланіну та їх пар геміні за допомогою провідності, напруження поверхневого рівня рівноваги та характеристики флуоресценції рівноважного. Було показано, що значення CMC Gemini було нижчим, порівнюючи мономер та Близнюки.
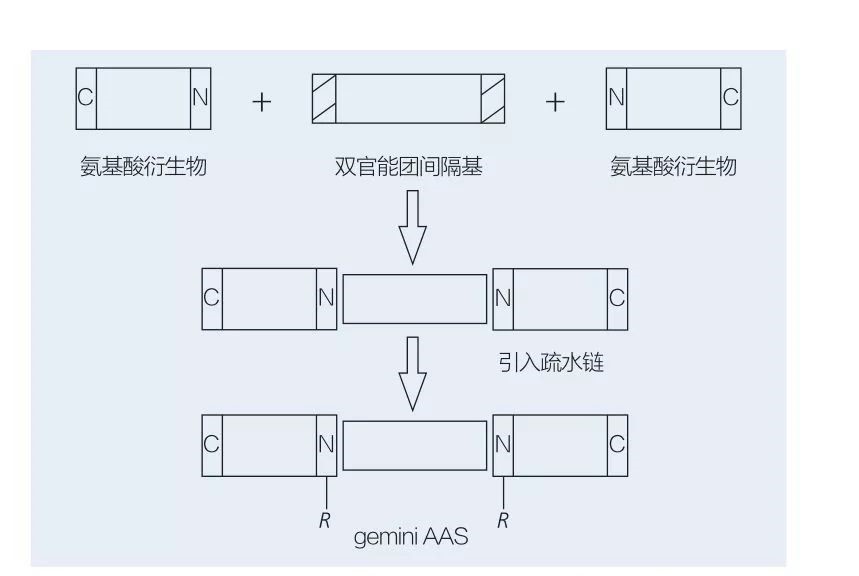
Фіг.6 Синтез Близнюків АА з використанням похідних та розпірків AA з подальшим введенням гідрофобної групи
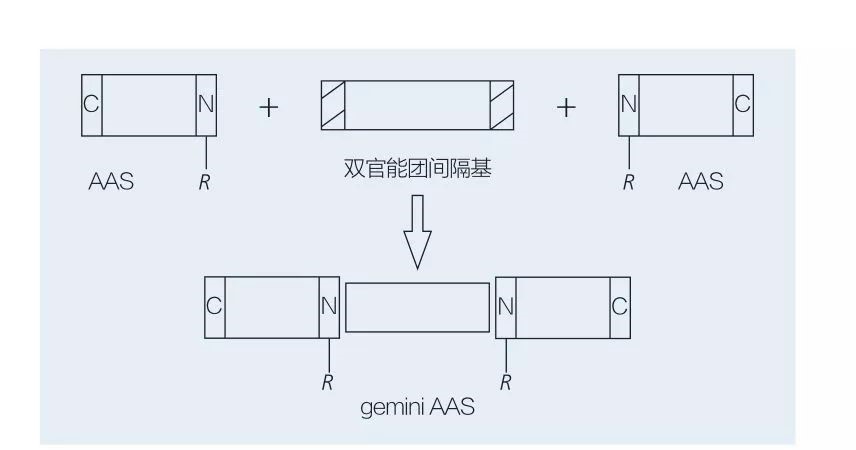
Фіг.7 Синтез Близнюків AASS з використанням біфункціонального спейсера та ААС
5.2.3 Синтез гліцероліпідних амінокислот/пептидних ПАР
Гліцероліпідні амінокислотні/пептидні поверхнево-активні речовини- це новий клас ліпідних амінокислот, які є структурними аналогами моно- (або ді-) ефірами та фосфоліпідами, завдяки їх структурі одного або двох жирних ланцюгів з однією амінокислотою, пов'язаною з основою гліцерину за допомогою ефірного зв’язку. Синтез цих поверхнево -активних речовин починається з препарату гліцеринових ефірів амінокислот при підвищеній температурі та в присутності кислого каталізатора (наприклад, BF 3). Синтез, каталізований фермент (з використанням гідролаз, протеаз та ліпази як каталізаторів) також є хорошим варіантом (мал. 8).
Повідомлялося, що проводиться синтез дилауралированих гліцеридів аргініну, каталізованих дилауралированими аргініновими гліцеридами за допомогою папаїна. Також повідомлялося про синтез кон'югатів ефірного ефіру діацилгліцерину та оцінки їх фізико -хімічних властивостей.
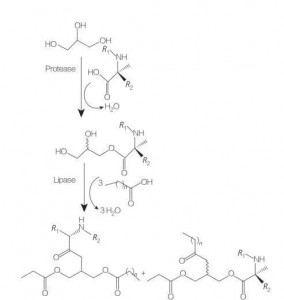
Фіг.8 Синтез кон'югатів амінокислот моно та діацилгліцерину
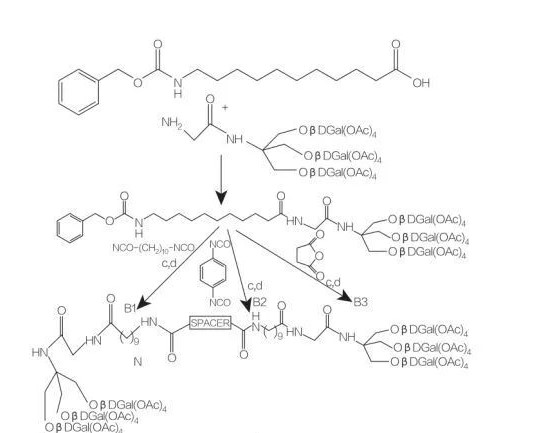
розпір: nh- (ch2)10-NH: CompoundB1
Спейсер: NH-C6H4-NH: CompoundB2
Спейсер: Ч.2-Ch2: compoundb3
Фіг.9 Синтез симетричних амфіфілів, отриманих з трис (гідроксиметил) амінометану
5.2.4 Синтез амінокислот/пептидних поверхнево-активних речовин на основі Боли
Амфіфіли типу боли на основі амінокислот містять 2 амінокислоти, які пов'язані з тим самим гідрофобним ланцюгом. Френсчі та ін. описав синтез амфіфій типу Бола з 2 амінокислотами (d- або l-аланіном або l-histidine) та 1 алкільним ланцюгом різної довжини та досліджував їх поверхневу активність. Вони обговорюють синтез та агрегацію нових амфіфій типу Бола з амінокислотною фракцією (використовуючи або нечасто β-амінокислоту, або алкоголь), і прокладку C12 -C20. Нечасті β-амінокислоти, що використовуються, може бути цукровою амінокислотою, азидотиміном (AZT), амінокислотою, норборновною амінокислотою та аміновим спиртом, отриманим з AZT (мал. 9). Синтез симетричних амфіфій типу Бола, отриманого з трис (гідроксиметил) амінометану (TRIS) (мал. 9).
06 Фізико -хімічні властивості
Добре відомо, що поверхнево -активні речовини на основі амінокислот (AAS) мають різноманітний та універсальний характер і мають хорошу застосовність у багатьох застосуванні, таких як хороша солюбілізація, хороші властивості емульгування, висока ефективність, висока ефективність поверхні та хороша стійкість до твердої води (толерантність іонів кальцію).
Виходячи з властивостей поверхнево -активної речовини амінокислот (наприклад, поверхневе натяг, CMC, фазова поведінка та температура Крафта), після широких досліджень були досягнуті наступні висновки - поверхнева активність АА перевершується до того, що його звичайна поверхнево -активна речовина.
6.1 Критична концентрація міцел (CMC)
Критична концентрація міцели є одним із важливих параметрів ПАР і регулює багато поверхневих активних властивостей, таких як солюбілізація, лізис клітин та його взаємодія з біоплівками тощо. Загалом, збільшення довжини ланцюга вуглеводневого хвоста (збільшення гідрофобності) призводить до зниження значення CMC розчину ПАР, що збільшує його поверхневу активність. Поверхнево -активні речовини на основі амінокислот зазвичай мають нижчі значення CMC порівняно зі звичайними поверхнево -активними речовинами.
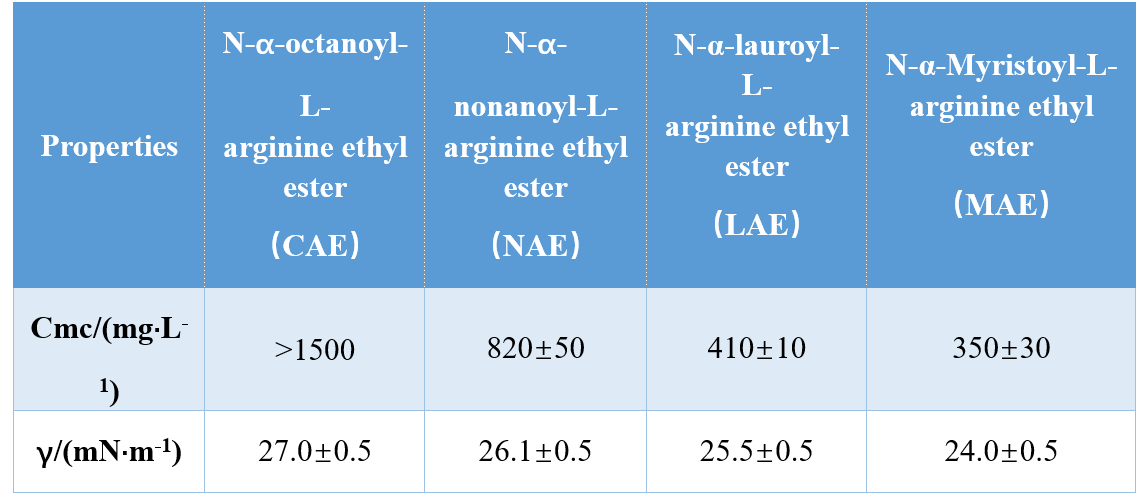
Через різні комбінації головних груп та гідрофобних хвостів (моно-катічний амід, двомаціональний амід, ефір на основі двомбаричного аміду), Infante et al. Синтезували три АА на основі аргініну та вивчали їх CMC та γCMC (поверхневий натяг при CMC), показавши, що значення CMC та γCMC зменшувались із збільшенням гідрофобної довжини хвоста. В іншому дослідженні Singare та Mhatre встановили, що CMC N-α-ациларгінінових поверхнево-активних речовин зменшився зі збільшенням кількості гідрофобних атомів вуглецю хвоста (табл. 1).
Yoshimura та ін. Досліджували CMC цистеїнової похідної амінокислотної поверхнево-активної речовини та показали, що КМК зменшується, коли довжина вуглецевої ланцюга в гідрофобному ланцюзі збільшувалася з 10 до 12. Подальше збільшення довжини вуглецю до 14 призвело до збільшення КМК, що підтвердило, що поверхневі препаратів довгого ланцюга мають нижчу тенденцію до агрегату.
Фаустіно та ін. повідомили про утворення змішаних міцел у водних розчинах аніонних поверхневих речовин Близнюків на основі цистину. Поверхнево -активні речовини Gemini також порівнювали з відповідними звичайними мономерними поверхнево -активними речовинами (C 8 Cys). Повідомлялося, що значення CMC сумішей ліпід-пуронніх речовин є нижчими, ніж у чистих поверхнево-активних речовин. Поверхнево-активні речовини Gemini та 1,2-дигепанойл-гліцерил-3-фосфохолін, водорозчинний, міцел-формування фосфоліпідів, мали CMC на мілімолярному рівні.
Шрестха та Арамакі досліджували утворення в'язкопружних глист-міцел у водних розчинах змішаних амінокислотних аніонно-неонічних поверхнево-активних речовин за відсутності солей домішок. У цьому дослідженні було виявлено, що N-додецил глутамат має більш високу температуру крафта; Однак при нейтралізації основною амінокислотою L-лізин він генерував міцели, і розчин почав поводитись як ньютонівська рідина при 25 ° С.
6.2 Хороша розчинність води
Хороша розчинність води AAS пояснюється наявністю додаткових зв'язків CO-NH. Це робить AAS більш біологічно розкладаним та екологічно чистим, ніж відповідні звичайні поверхнево -активні речовини. Вода розчинність N-Aco-L-глутамінової кислоти ще краща завдяки 2 карбоксильним групам. Вода розчинність CN (CA) 2 також хороша, оскільки в 1 молекулі існує 2 іонні аргінінові групи, що призводить до більш ефективної адсорбції та дифузії на клітинному інтерфейсі та навіть ефективного гальмування бактерій при менших концентраціях.
6.3 Температура Крафта та Крафт -точка
Температуру Крафта можна розуміти як специфічну поведінку розчинності ПАР, розчинність яких різко збільшується вище певної температури. Іонні поверхнево -активні речовини мають тенденцію до генерування твердих гідратів, які можуть осаджувати з води. При певній температурі (так звана температура Краффта) зазвичай спостерігається різке і розривне збільшення розчинності ПАР. Крафт -точка іонної поверхнево -активної речовини - це його температура крафта при CMC.
Ця характеристика розчинності зазвичай спостерігається для іонних поверхнево -активних речовин і її можна пояснити наступним чином: Розчинність мономеру вільного поверхнево -активного речовини обмежена нижче температури Крафта до досягнення точки Крафта, де її розчинність поступово зростає за рахунок утворення міцел. Для забезпечення повної розчинності необхідно підготувати рецептури ПАР при температурі вище точки Крафта.
Температура Краффта AAS була вивчена та порівнювалася зі звичайними синтетичними поверхнево-активними речовинами. Шрестха та Арамакі вивчали температуру Краффта на основі аргініну ААС і виявили, що критична концентрація міцели виявляла поведінку агрегації у формі передміщин, що перевищують 2-5 × 10-6 моль -1 -1 -1 -1-ти типах, що не мають шість років, а також шість років, що не відрізняється від шестигранів, що відрізняються від шестигранників, а також шістьма-хамсади-формаційними і-хамами, що мають шість Hemsecad. і обговорював взаємозв'язок між їх температурою Крафта та амінокислотними залишками.
В експериментах було встановлено, що температура Krafft N-гексадеканоїлу AAS зростала зі зниженням розміру амінокислотних залишків (фенілаланіну є винятком), тоді як тепло розчинності (поглинання тепла) збільшується зі зменшенням розміру амінокислотних залишків (за винятком гліцину та фенілаланіну). Було зроблено висновок, що як в аланінових, так і в фенілаланінових системах взаємодія DL сильніша, ніж взаємодія LL у твердій формі N-гексадеканойлу AAS солі.
Бріто та ін. Визначив температуру Krafft трьох рядів нових поверхнево-активних речовин на основі амінокислот з використанням диференціальної скануючої мікрокалоририметрії і виявив, що зміна трифторуацетату іона на іон йодиду призвела до значного підвищення температури Краффта (приблизно 6 ° С) від 47 ° С до 53 ° С. Наявність цис-дубльних зв’язків та ненасичення, що присутня в довголанцюгових похіднихах, призвело до значного зниження температури Крафта. Повідомлялося, що N-додецил глутамат має більш високу температуру Крафта. Однак нейтралізація з основною амінокислотою L-лізином призвела до утворення міцел у розчині, що поводилися як ньютонівські рідини при 25 ° С.
6.4 поверхневий натяг
Поверхневе натяг поверхнево -активних речовин пов'язаний з довжиною ланцюга гідрофобної частини. Чжан та ін. Визначив поверхневе натяг гліцинату кокойлу натрію методом пластини Вільгельмі (25 ± 0,2) ° С і визначив значення поверхневого натягу при CMC як 33 мн -м -1, CMC як 0,21 ммоль -L -1. Yoshimura та ін. Визначив поверхневий натяг 2C N Cys типу амінокислотного поверхневого натягу поверхневого натягу 2C N поверхневих агентів на основі Cys. Було встановлено, що поверхневий натяг при CMC зменшувалося зі збільшенням довжини ланцюга (до n = 8), тоді як тенденція була зворотна для поверхнево -активних речовин з n = 12 або довшою довжиною ланцюга.
Також було вивчено вплив CAC1 2 на поверхневе натяг дикарбоксильованих амінокислотних поверхнево-активних речовин. У цих дослідженнях CAC1 2 додавали до водних розчинів трьох дикарбоксильованих амінокислотних поверхнево-активних речовин (C12 Malna 2, C12 ASPNA 2 та C12 Gluna 2). Значення плато після CMC порівнювали, і було встановлено, що поверхневий натяг зменшувався при дуже низьких концентраціях CAC1 2. Це пояснюється впливом іонів кальцію на розташування поверхнево-активної речовини на інтерфейсі газової води. З іншого боку, поверхнева напруга солей N-додециламалонату та N-додецилаласпарату також була майже постійною до 10 ммоль-L -1 CAC1 2. Вище 10 ммоль -L -1 поверхневий натяг різко збільшується через утворення осадження кальцієвої солі ПАР. Для солі Disodium N-додецил глутамату помірне додавання CAC1 2 призвело до значного зниження поверхневого натягу, тоді як тривале збільшення концентрації CAC1 2 більше не спричиняло значних змін.
Для визначення кінетики адсорбції AAS типу Gemini на інтерфейсі газо-вода динамічне поверхневе натяг визначали за допомогою методу максимального міхура тиску. Результати показали, що протягом найдовшого тестового часу динамічне поверхневе натяг 2c 12 не змінювався. Зниження динамічного поверхневого натягу залежить лише від концентрації, довжини гідрофобних хвостів та кількості гідрофобних хвостів. Збільшення концентрації ПАР, зменшення довжини ланцюга, а також кількість ланцюгів призвело до більш швидкого розпаду. Результати, отримані для більш високих концентрацій C N Cys (n = 8 до 12), були виявлені дуже близькими до γ CMC, виміряного методом Вільгельмі.
В іншому дослідженні динамічна поверхнева напруга цистину натрію (SDLC) та цистину натрію Дідекаміно визначали методом пластини Вільгельмі, а крім того, рівноважна поверхня напруги їх водних розчинів визначалася методом об'ємного краплі. Реакцію дисульфідних зв’язків також досліджували і іншими методами. Додавання Mercaptoethanol до 0,1 ммоль -L -1SDLC розчину призвело до швидкого збільшення поверхневого натягу від 34 мн -м -1 до 53 мн -м -1. Оскільки NaClo може окислювати дисульфідні зв’язки SDLC до груп сульфонової кислоти, агрегати не спостерігалося, коли NACLO (5 ммоль -L -1) додавали до розчину SDLC 0,1 ммоль -L -1. Електронна мікроскопія та динамічні результати розсіювання світла показали, що в розчині не утворювалося агрегати. Було виявлено, що поверхневе натяг SDLC збільшується з 34 мн -м -1 до 60 мн -м -1 протягом 20 хв.
6.5 Взаємодія двійкової поверхні
У науках про життя ряд груп вивчали вібраційні властивості сумішей катіонних АА (діацилгліцеринові поверхнево-активні речовини) та фосфоліпіди на інтерфейсі газовода, нарешті, підсумовуючи, що ця неідеальна властивість спричиняє поширеність електростатичних взаємодій.
6.6 Властивості агрегації
Динамічне розсіювання світла зазвичай використовується для визначення властивостей агрегації мономерів на основі амінокислот та поверхнево-активних речовин Gemini в концентраціях вище CMC, що дає очевидний гідродинамічний діаметр DH (= 2R H). Агрегати, утворені C N Cys та 2CN Cys, є відносно великими і мають широкий розподіл масштабу порівняно з іншими ПАР. Усі поверхнево -активні речовини, крім 2c 12 Cys, зазвичай утворюють агрегати близько 10 нм. Розміри поверхневих речовин Близнюків значно більші, ніж у їхніх мономерних аналогів. Збільшення довжини вуглеводного ланцюга також призводить до збільшення розміру міцели. Ohta та ін. Охарактеризують властивості агрегації трьох різних стереоізомерів N-додецил-феніл-аланіл-феніл-аланіну тетраметиламмонію у водному розчині і показали, що діастереоізомери мають однакову критичну концентрацію агрегації у водному розчині. Iwahashi та ін. investigated by circular dichroism, NMR and vapor pressure osmometry the The formation of chiral aggregates of N-dodecanoyl-L-glutamic acid, N-dodecanoyl-L-valine and their methyl esters in different solvents (such as tetrahydrofuran, acetonitrile, 1,4-dioxane and 1,2-dichloroethane) with rotational properties was investigated by circular Дихроїзм, ЯМР та Омометрія тиску пари.
6.7 Міжфазна адсорбція
Міжфазна адсорбція поверхнево-активних речовин на основі амінокислот та порівняння з його звичайним аналогом також є одним із напрямків дослідження. Наприклад, досліджували міжфазні адсорбційні властивості додецильних ефірів ароматичних амінокислот, отриманих з LET та LEP. Результати показали, що Let і LEP демонстрували нижчі міжфазні ділянки на інтерфейсі газо-рідини та на інтерфейсі води/гексану відповідно.
Бордес та ін. Досліджували поведінку розчину та адсорбцію на газоводному інтерфейсі трьох дикарбоксильованих амінокислотних поверхнево-активних речовин, солі дидентів додецил глутамату, додецил аспартату та аміномалонату (з 3, 2 та 1 атомами вуглецю між двома карбоксильними групами відповідно). Згідно з цим звітом, CMC дикарбоксильованих поверхнево-активних речовин був у 4-5 разів вище, ніж у монокарбоксильованої додецилгліцинової солі. Це пояснюється утворенням водневих зв’язків між дикарбоксильованими поверхнево -активними речовинами та сусідніми молекулами через амідні групи.
6.8 Фазова поведінка
Ізотропні переривчасті кубічні фази спостерігаються для поверхнево -активних речовин у дуже високих концентраціях. Молекули поверхнево -активної речовини з дуже великими групами голови, як правило, утворюють агрегати меншої позитивної кривизни. Marques et al. вивчала фазова поведінка систем 12lys12/12Ser та 8lys8/16Ser (див. Рис. 10), а результати показали, що система 12lys12/12Ser має зону поділу фази між міцелярною та везикулярною областями розчину, тоді Область фази везикули). Слід зазначити, що для області везикул системи 12lys12/12Ser везикули завжди співіснують з міцелами, тоді як область везикул системи 8lys8/16Ser має лише везикули.
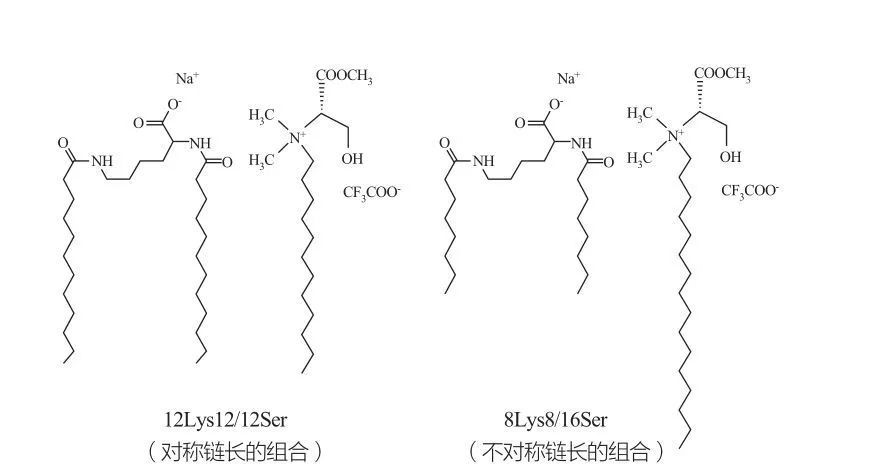
Катаніонні суміші поверхнево-активних речовин на основі лізину та серину: симетричні 12lys12/12Ser пара (ліворуч) та асиметрична пара 8lys8/16Ser (праворуч)
6.9 Емульгуючі здібності
Kouchi et al. досліджували емульгуючу здатність, міжфазну напругу, дисперсність та в'язкість N- [3-додецил-2-гідроксипропіл] -l-аргінін, L-глутамат та інші АА. У порівнянні з синтетичними ПАР (їх звичайними неіонними та амфотеричними аналогами), результати показали, що АА має сильнішу емульгуючу здатність, ніж звичайні поверхнево -активні речовини.
Baczko та ін. Синтезовані нові аніонні поверхнево -активні речовини амінокислот та досліджували їх придатність як хірально орієнтовані ЯМР -спектроскопічні розчинники. Серія похідних Amphiphilic L-PHE або L-ALA з різними гідрофобними хвостами (пентил ~ тетрадецил) синтезується шляхом реагування амінокислот з O-сульфобензойним ангідридом. Ву та ін. синтезовані солі натрію N-Fatty Acyl AAS тадосліджували їх здатність до емульгування в емульсіях з маслом у воді, і результати показали, що ці поверхнево-активні речовини працювали краще з етилацетатом як нафтовою фазою, ніж з N-гексаном як нафтовою фазою.
6.10 Успіхи в синтезі та виробництві
Жорсткий водостійкість можна розуміти як здатність ПАР протистояти наявності іонів, таких як кальцій та магній у твердій воді, тобто здатність уникати осадження в кальційські мила. Поверхнево -активні речовини з високою твердим водостійкістю дуже корисні для рецептур миючих засобів та засобів особистої гігієни. Твердий водостійкість можна оцінити шляхом обчислення зміни розчинності та поверхневої активності ПАР у присутності іонів кальцію.
Ще один спосіб оцінити стійкість до водної стійкості - це обчислення відсотків або грам поверхнево -активної речовини, необхідних для мила кальцію, що утворюється від 100 г олеату натрію, щоб диспергуватися у воді. У районах з високою жорсткою водою високі концентрації іонів кальцію та магнію та вмісту мінералів можуть ускладнити деякі практичні застосування. Часто іон натрію використовується як лічильник синтетичного аніонного ПАР. Оскільки двовалентний іон кальцію пов'язаний з обома молекулами ПАР, це призводить до того, що ПАР легко осаджується від розчину, що робить все більшу ймовірність.
Дослідження твердості водостійкості AAS показало, що на кислоту та тверду стійкість до води сильно вплинули додаткова карбоксильна група, а кислота та тверда стійкість до водної стійкості ще більше збільшуються зі збільшенням довжини спейсерської групи між двома карбоксильними групами. Порядок кислотної та твердості водостійкості становив C 12 гліцинат <c 12 аспартат <c 12 глутамат. Порівнюючи дикарбоксильовану амідну зв’язок та дикарбоксильовану аміно -поверхневу речовину, було встановлено, що діапазон рН останнього був ширшим, а його поверхнева активність збільшувалася з додаванням відповідної кількості кислоти. Дікарбоксильована N-алкил-амінокислоти показала хелатуруючу дію в присутності іонів кальцію, а C 12 аспарттував білий гель. C 12 Глутамат виявляв високу поверхневу активність при високій концентрації Са 2+ і, як очікується, буде використаний при опрісненні морської води.
6.11
Дисперсійність відноситься до здатності поверхнево -активної речовини запобігти злиття та осідання поверхнево -активної речовини в розчині.Дисперсійність є важливою властивістю ПАР, що робить їх придатними для використання в миючих засобах, косметиці та фармацевтичних препаратах.Дисперсний засіб повинен містити ефір, ефір, амідний або аміно -зв’язок між гідрофобною групою та кінцевою гідрофільною групою (або серед прямих ланцюгів гідрофобних груп).
Як правило, аніонні поверхнево -активні речовини, такі як алканоламідо сульфати та амфотеричні поверхнево -активні речовини, такі як амідосульфобетайн, особливо ефективні, як диспергування для кальцієвого мила.
Багато дослідницьких зусиль визначили дисперсність АА, де N-lauroyl лізин виявився погано сумісним з водою і важким у використанні для косметичних рецептур.У цій серії основні амінокислоти, що заміщуються N-ацил, мають чудову дисперсність і використовуються в косметичній промисловості для поліпшення рецептур.
07 токсичність
Звичайні поверхнево -активні речовини, особливо катіонні поверхнево -активні речовини, є високотоксичними для водних організмів. Їх гостра токсичність обумовлена явищем взаємодії адсорбційної іонної поверхнево-активної речовини на інтерфейсі клітинної води. Зниження CMC поверхнево -активних речовин зазвичай призводить до сильнішої міжфазної адсорбції ПАР, що зазвичай призводить до підвищеної гострої токсичності. Збільшення довжини гідрофобного ланцюга ПАР також призводить до збільшення гострої токсичності ПАР.Більшість АА є низькими або нетоксичними для людини та навколишнього середовища (особливо для морських організмів) і підходять для використання в якості харчових інгредієнтів, фармацевтичних препаратів та косметики.Багато дослідників продемонстрували, що поверхнево-активні речовини амінокислот лагідні та не надходять до шкіри. Відомо, що поверхнево-активні речовини на основі аргініну менш токсичні, ніж їх звичайні аналоги.
Бріто та ін. вивчали фізико-хімічні та токсикологічні властивості амінокислотних амфіфій та їх [похідних тирозину (Tyr), гідроксипроліну (Hyp), серину (SER) та лізину (Lys)] спонтанного утворення катіонних везикул та даних про їх гострою токсичність до Дафнії Магни (RIC 50). Вони синтезували катіонні везикули додецилтриметиламмонію броміду (DTAB)/похідних Lys та/або сервер/похідними лізами та перевіряли їх екотоксичність та гемолітичний потенціал, показуючи, що всі AAS та їх суміші, що містять везикули, були менш токтичними, ніж звичайні діапазони.
Роза та ін. досліджували зв'язування (асоціація) ДНК до стабільних катіонних везикул на основі амінокислот. На відміну від звичайних катіонних поверхнево-активних речовин, які часто здаються токсичними, взаємодія катіонних амінокислотних поверхнево-активних речовин виявляється нетоксичною. Катічний АА заснований на аргініні, який спонтанно утворює стабільні везикули в поєднанні з певними аніонними ПАР. Повідомляється, що інгібітори корозії на основі амінокислот також нетоксичні. Ці поверхнево -активні речовини легко синтезуються з високою чистотою (до 99%), низькою вартістю, легко розкладаються та повністю розчинними у водних носіях. Кілька досліджень показали, що поверхнево-активні речовини, що містять сірку, що містять сірку, вищі за інгібування корозії.
У недавньому дослідженні Perinelli et al. повідомили про задовільний токсикологічний профіль рамноліпідів порівняно зі звичайними поверхнево -активними речовинами. Відомо, що рамноліпіди діють як підсилювачі проникності. Вони також повідомили про вплив рамноліпідів на епітеліальну проникність макромолекулярних препаратів.
08 Антимікробна активність
Антимікробну активність поверхнево -активних речовин можна оцінити за допомогою мінімальної інгібіторної концентрації. Докладно вивчалася антимікробна активність поверхнево-активних речовин на основі аргініну. Було виявлено, що грамнегативні бактерії є більш стійкими до поверхнево-активних речовин на основі аргініну, ніж грампозитивні бактерії. Антимікробна активність поверхнево -активних речовин зазвичай збільшується на наявність гідроксильних, циклопропану або ненасичених зв’язків всередині ацильних ланцюгів. Castillo et al. показали, що довжина ацильних ланцюгів та позитивний заряд визначають значення HLB (гідрофільний ліпофільний баланс) молекули, і вони впливають на їх здатність порушувати мембрани. Nα-ациларгініновий метиловий ефір-ще один важливий клас катіонних поверхнево-активних речовин з антимікробною активністю широкого спектру дії, і він легко біологічно розкладається і має низьку або відсутність токсичності. Дослідження взаємодії поверхнево-активних речовин на основі метилового ефіру Nα-ациларгініну з 1,2-дипалмітоїл-Propyltrioxyl-3-фосфорилхоліном та 1,2-дезетрадеканоїл-пропілтріоксил-3-фосфорилхоліном, що демонструють цю оперативну діапазон, і на наявності діапазонів, що знаходяться на наявності діапазонів, що діють на наявність виконавчих діапазонів. Антимікробні результати показали, що поверхнево -активні речовини мають хорошу антибактеріальну активність.
09 Реологічні властивості
Реологічні властивості ПАР відіграють дуже важливу роль у визначенні та прогнозуванні їх застосування в різних галузях, включаючи продукти харчування, фармацевтичні препарати, видобуток нафти, засоби особистої допомоги та домашні засоби. Було проведено багато досліджень для обговорення взаємозв'язку в'язкопружності поверхнево -активних речовин амінокислот та CMC.
10 застосувань у косметичній галузі
AAS використовується у формулюванні багатьох засобів особистої гігієни.Гліцинат калію N-кокоїл виявляється ніжним на шкірі і використовується в очищенні обличчя для видалення мулу та макіяжу. N-Acol-L-глутамінова кислота має дві карбоксильні групи, що робить її більш розчинною водою. Серед цих AAS AAS на основі C 12 жирних кислот широко використовується при очищенні обличчя для видалення мулу та макіяжу. AAS з ланцюгом C 18 використовується як емульгатори в засобах по догляду за шкірою, і, як відомо, солі N-Lauryl Alanine створюють вершкові піни, які не дратують шкіру і тому можуть бути використані при рецептурі засобів догляду за немовлятами. AAS на основі N-Lauryl, що використовується в зубній пасті, мають хорошу деталізацію, подібну до мила та сильної ефективності інгібіції ферментів.
Протягом останніх кількох десятиліть вибір поверхнево -активної речовини для косметики, засобів особистої гігієни та фармацевтичних препаратів зосередився на низькій токсичності, м'якості, лагідності до дотику та безпеки. Споживачі цих продуктів гостро усвідомлюють потенційне подразнення, токсичність та фактори навколишнього середовища.
Сьогодні AAS використовується для формування багатьох шампунів, барвників для волосся та мила для ванни завдяки їх численним перевагам перед їх традиційними колегами в косметиці та засобах особистої гігієни.Поверхнево-активні речовини на основі білка мають бажані властивості, необхідні для засобів особистої гігієни. Деякі АА мають можливості формування плівок, а інші мають хороші можливості піноутворення.
Амінокислоти є важливими природними зволожуючими факторами в рогові прошарки. Коли епідермальні клітини помирають, вони стають частиною рогового прошарку, а внутрішньоклітинні білки поступово деградують до амінокислот. Потім ці амінокислоти транспортують далі в рогові прошарки, де вони поглинають жирові або жироподібні речовини в рогові епідермальні прошарки, тим самим покращуючи еластичність поверхні шкіри. Приблизно 50% природного зволожуючого фактора шкіри складається з амінокислот та пірролідону.
Колаген, звичайний косметичний інгредієнт, також містить амінокислоти, які підтримують шкіру м’якою.Шкірні проблеми, такі як шорсткість і тьмяність, значною мірою пов'язані з відсутністю амінокислот. Одне дослідження показало, що змішування амінокислоти з мазь, полегшеним опіками шкіри, і уражені ділянки повернулися до їх нормального стану, не стаючи келоїдними шрами.
Амінокислоти також були дуже корисними для догляду за пошкодженими кутикулами.Сухі безформні волосся можуть вказувати на зниження концентрації амінокислот у сильно пошкодженому рогові прошарки. Амінокислоти мають здатність проникати в кутикулу в вал волосся і поглинати вологу з шкіри.Ця здатність поверхнево -активних речовин на основі амінокислот робить їх дуже корисними для шампунів, барвників волосся, пом'якшувачів волосся, кондиціонерів для волосся та наявності амінокислот робить волосся сильними.
11 Застосування в повсякденній косметиці
В даний час зростає попит на рецептури миючих засобів на основі амінокислот у всьому світі.Відомо, що AAS має кращу здатність до чищення, здатність до піни та пом'якшення тканин, що робить їх придатними для домашніх миючих засобів, шампунів, миття тіла та інших застосувань.Повідомляється, що амфотер AAS з аспарагіновою кислотою є високоефективним миючим засобом з хелатними властивостями. Було виявлено, що використання інгредієнтів миючих засобів, що складаються з N-алкил-β-аміноетокси-кислот для зменшення подразнення шкіри. Повідомлялося, що формулювання рідкого миючого засобу, що складається з N-кокоїл-β-амінопропіонату, є ефективним миючим засобом для плям нафти на металевих поверхнях. ПАР амінокарбонової кислоти, C 14 Chohch 2 NHCH 2 COONA, також показано, що він має кращу деталізацію і використовується для очищення текстилю, килимів, волосся, скла тощо.
Підготовка препаратів миючих засобів на основі N- (N'-ланцюгового ацил-β-аланілу) -β-аланіну повідомляла Кейго та Тацуя у патенті для кращої здатності та стабільності, легкого розбиття піни та гарного пом'якшення тканин. Као розробив рецептуру миючого засобу на основі N-ацил-1-н-гідрокси-β-аланіну та повідомив про низьке подразнення шкіри, високу стійкість до води та високу потужність видалення плям.
Японська компанія Ajinomoto використовує низькотоксичну та легко розкладається AAS на основі L-глутамінової кислоти, L-аргініну та L-лізину як основних інгредієнтів шампунів, миючих засобів та косметики (мал. 13). Повідомлялося також про здатність ферментів у препаратах миючих засобів видаляти забруднення білка. Повідомлялося про N-ацил AAS, отриманий з глутамінової кислоти, аланіну, метилгліцину, серину та аспарагінної кислоти для їх використання як відмінні рідкі миючі засоби у водних розчинах. Ці поверхнево -активні речовини взагалі не збільшують в'язкість навіть при дуже низьких температурах, і їх можна легко перенести з судна для зберігання піноутворення для отримання однорідних пінів.
Час посади: червень-09-2022

