Зміст цієї статті:
1. Розвиток амінокислот
2. Структурні властивості
3. Хімічний склад
4.Класифікація
5. Синтез
6. Фізико-хімічні властивості
7. Токсичність
8. Антимікробна активність
9. Реологічні властивості
10. Застосування в косметичній промисловості
11. Застосування в повсякденній косметиці
Амінокислотні поверхнево-активні речовини (AAS)є класом поверхнево-активних речовин, утворених шляхом поєднання гідрофобних груп з однією або кількома амінокислотами.У цьому випадку амінокислоти можуть бути синтетичними або отриманими з білкових гідролізатів або подібних відновлюваних джерел.У цьому документі детально описано більшість доступних шляхів синтезу ААС і вплив різних шляхів на фізико-хімічні властивості кінцевих продуктів, включаючи розчинність, стабільність дисперсії, токсичність і здатність до біологічного розкладання.Як клас поверхнево-активних речовин, попит на який зростає, універсальність ААС завдяки їх змінній структурі пропонує велику кількість комерційних можливостей.
Враховуючи, що поверхнево-активні речовини широко використовуються в мийних засобах, емульгаторах, інгібіторах корозії, третинному видобутку нафти та фармацевтичних препаратах, дослідники ніколи не припиняли приділяти увагу поверхнево-активним речовинам.
Поверхнево-активні речовини є найбільш типовими хімічними продуктами, які щодня споживаються у великих кількостях у всьому світі та мають негативний вплив на водне середовище.Дослідження показали, що широке використання традиційних поверхнево-активних речовин може мати негативний вплив на навколишнє середовище.
Сьогодні нетоксичність, здатність до біологічного розкладання та біосумісність є майже такими ж важливими для споживачів, як корисність і ефективність поверхнево-активних речовин.
Біосурфактанти — це екологічно чисті стійкі поверхнево-активні речовини, які природним чином синтезуються мікроорганізмами, такими як бактерії, гриби та дріжджі, або виділяються позаклітинно.Таким чином, біоповерхнево-активні речовини також можуть бути отримані за допомогою молекулярного дизайну для імітації природних амфіфільних структур, таких як фосфоліпіди, алкілглікозиди та ацил-амінокислоти.
Амінокислотні поверхнево-активні речовини (ААС)є одними з типових поверхнево-активних речовин, які зазвичай виробляються з тваринної або сільськогосподарської сировини.Протягом останніх двох десятиліть ААС викликали великий інтерес вчених як нові поверхнево-активні речовини не тільки тому, що їх можна синтезувати з відновлюваних ресурсів, але також тому, що ААС легко розкладаються та мають нешкідливі побічні продукти, що робить їх безпечнішими для людини. навколишнє середовище.
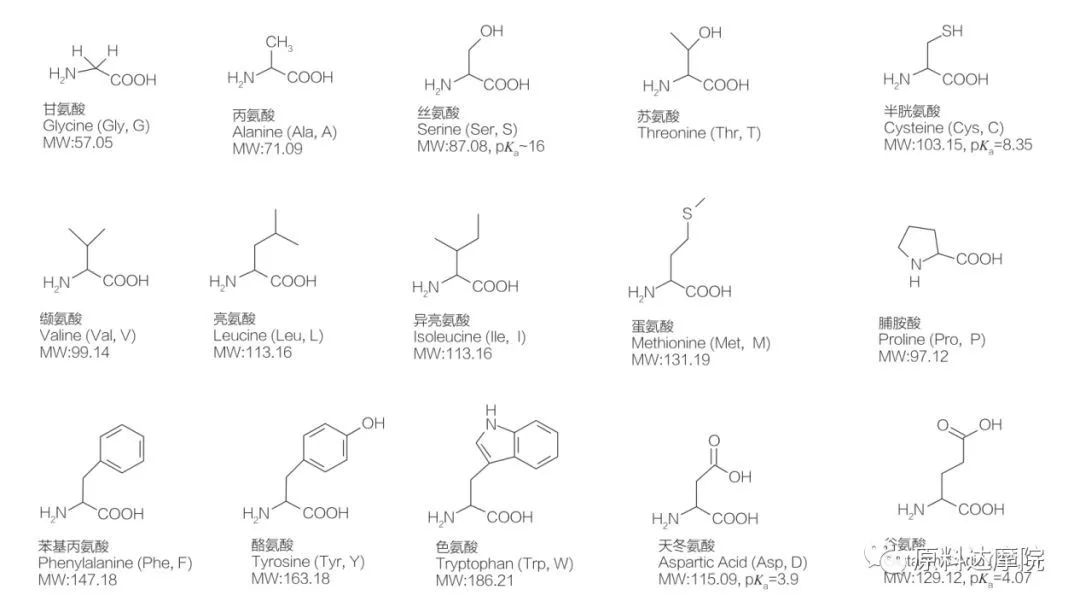
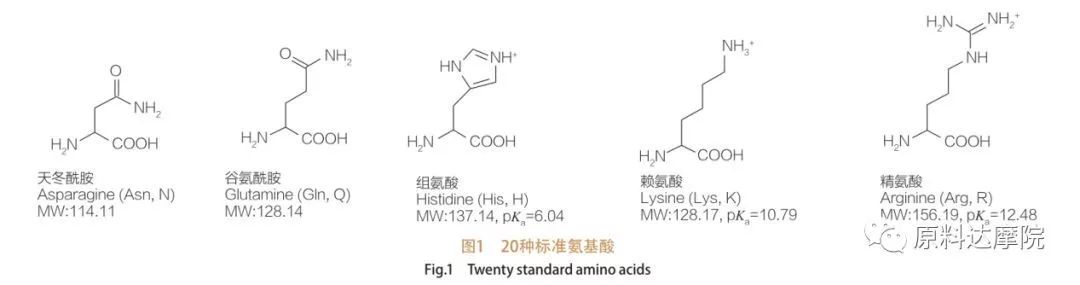
ААС можна визначити як клас поверхнево-активних речовин, що складається з амінокислот, що містять амінокислотні групи (HO 2 C-CHR-NH 2) або амінокислотні залишки (HO 2 C-CHR-NH-).Дві функціональні області амінокислот дозволяють отримувати широкий спектр поверхнево-активних речовин.Відомо, що в природі існує 20 стандартних протеїногенних амінокислот, які відповідають за всі фізіологічні реакції росту та життєдіяльності.Вони відрізняються один від одного лише залишком R (рис. 1, pk a – від’ємний логарифм константи кислотної дисоціації розчину).Деякі неполярні та гідрофобні, деякі полярні та гідрофільні, деякі основні, а деякі кислотні.
Оскільки амінокислоти є відновлюваними сполуками, поверхнево-активні речовини, синтезовані з амінокислот, також мають високий потенціал стати стійкими та екологічно чистими.Проста і природна структура, низька токсичність і швидке біологічне розкладання часто роблять їх кращими, ніж звичайні поверхнево-активні речовини.Використовуючи відновлювану сировину (наприклад, амінокислоти та рослинні олії), ААС можна виробляти різними біотехнологічними та хімічними способами.
На початку 20 століття було вперше виявлено, що амінокислоти використовуються як субстрати для синтезу поверхнево-активних речовин.ААС в основному використовувалися як консерванти у фармацевтичних і косметичних препаратах.Крім того, було виявлено, що ААС є біологічно активними проти різноманітних хвороботворних бактерій, пухлин і вірусів.У 1988 році доступність недорогих ААС викликала дослідницький інтерес до поверхневої активності.Сьогодні, з розвитком біотехнології, дріжджі також можуть промислово синтезувати деякі амінокислоти у великих масштабах, що опосередковано доводить, що виробництво ААС є більш екологічним.
01 Розвиток амінокислот
Ще на початку 19-го століття, коли вперше були виявлені природні амінокислоти, передбачалося, що їх структури будуть надзвичайно цінними — їх можна використовувати як сировину для приготування амфіфілів.Перше дослідження синтезу ААС було проведено Бонді в 1909 році.
У цьому дослідженні N-ацилгліцин і N-ацилаланін були введені як гідрофільні групи для поверхнево-активних речовин.Подальша робота включала синтез ліпоамінокислот (AAS) з використанням гліцину та аланіну, а Hentrich et al.опублікував серію висновків,включаючи першу патентну заявку на використання солей ацилсаркозинату та ациласпартату як поверхнево-активних речовин у побутових миючих засобах (наприклад, шампуні, миючі засоби та зубні пасти).Згодом багато дослідників досліджували синтез і фізико-хімічні властивості ацил-амінокислот.На сьогоднішній день опубліковано велику кількість літератури щодо синтезу, властивостей, промислового застосування та здатності до біологічного розкладання ААС.
02 Структурні властивості
Неполярні гідрофобні ланцюги жирних кислот ААС можуть відрізнятися за структурою, довжиною ланцюга та кількістю.Структурна різноманітність і висока поверхнева активність ААС пояснюють їх широке різноманіття складу та фізико-хімічних і біологічних властивостей.Головні групи ААС складаються з амінокислот або пептидів.Відмінності в головних групах визначають адсорбційну, агрегаційну та біологічну активність цих ПАР.Потім функціональні групи в головній групі визначають тип ААС, включаючи катіонну, аніонну, неіонну та амфотерну.Комбінація гідрофільних амінокислот і гідрофобних довголанцюгових частин утворює амфіфільну структуру, яка робить молекулу високоактивною на поверхні.Крім того, наявність асиметричних атомів вуглецю в молекулі сприяє утворенню хіральних молекул.
03 Хімічний склад
Усі пептиди та поліпептиди є продуктами полімеризації цих майже 20 α-протеїногенних α-амінокислот.Усі 20 α-амінокислот містять функціональну групу карбонової кислоти (-COOH) і функціональну аміногрупу (-NH 2), обидві приєднані до одного тетраедричного α-атома вуглецю.Амінокислоти відрізняються одна від одної різними R-групами, приєднаними до α-вуглецю (за винятком ліцину, де R-група є воднем). R-групи можуть відрізнятися за структурою, розміром і зарядом (кислотність, лужність).Ці відмінності також визначають розчинність амінокислот у воді.
Амінокислоти є хіральними (крім гліцину) і є оптично активними за своєю природою, оскільки вони мають чотири різні замісники, пов’язані з альфа-вуглецем.Амінокислоти мають дві можливі конформації;вони є дзеркальними відображеннями один одного, які не перекриваються, незважаючи на те, що кількість L-стереоізомерів значно вища.R-група, присутня в деяких амінокислотах (фенілаланін, тирозин і триптофан), є арилом, що забезпечує максимальне поглинання УФ-променів при 280 нм.Кислий α-COOH і основний α-NH 2 в амінокислотах здатні до іонізації, і обидва стереоізомери, якими б вони не були, утворюють іонізаційну рівновагу, показану нижче.
R-COOH ↔R-COO-+H+
R-NH3+↔R-NH2+H+
Як показано в іонізаційній рівновазі вище, амінокислоти містять щонайменше дві слабокислі групи;однак карбоксильна група є набагато більш кислою порівняно з протонованою аміногрупою.pH 7,4, карбоксильна група депротонована, тоді як аміногрупа протонована.Амінокислоти з неіонізованими групами R є електрично нейтральними при цьому pH і утворюють цвітеріон.
04 Класифікація
ААС можна класифікувати за чотирма критеріями, які по черзі описані нижче.
4.1 За походженням
| За походженням ААС можна розділити на 2 категорії. ① Природна категорія Деякі природні сполуки, що містять амінокислоти, також мають здатність зменшувати поверхневий/міжфазний натяг, а деякі навіть перевищують ефективність гліколіпідів.Ці ААС також відомі як ліпопептиди.Ліпопептиди - це низькомолекулярні сполуки, які зазвичай продукуються видами Bacillus.
Такі ААС далі поділяються на 3 підкласи:сурфактин, ітурин і фенгіцин.
|
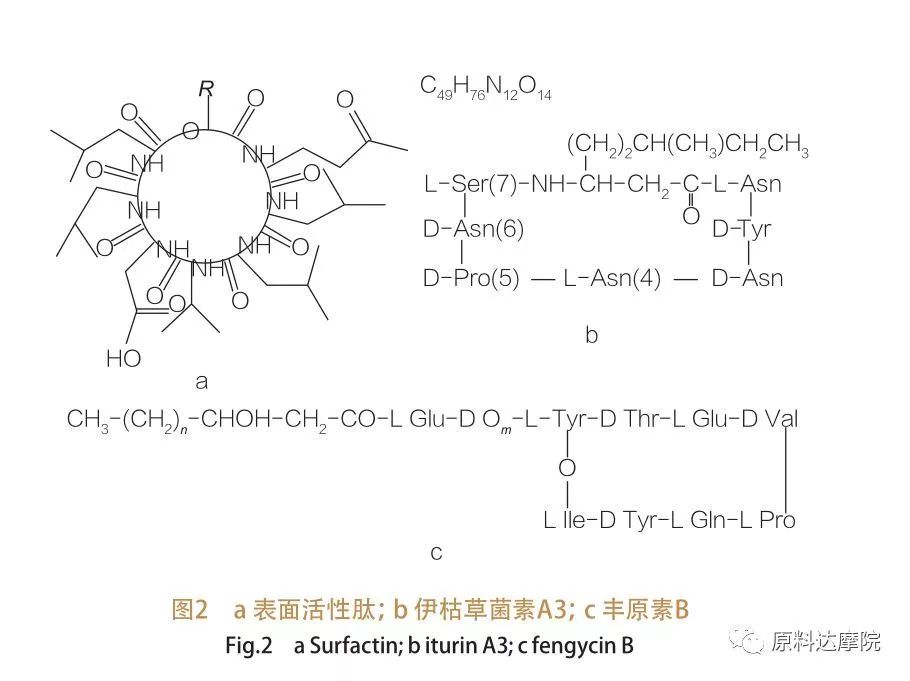
| Сімейство поверхнево-активних пептидів охоплює гептапептидні варіанти різноманітних речовин,як показано на малюнку 2а, на якому ланцюг C12-C16 ненасиченої β-гідроксижирної кислоти пов’язаний з пептидом.Поверхнево-активний пептид є макроциклічним лактоном, в якому кільце замкнуте в результаті каталізу між С-кінцем β-гідроксижирної кислоти та пептидом. У підкласі ітурину існує шість основних варіантів, а саме ітурин A і C, мікосубтилін і бациломіцин D, F і L.У всіх випадках гептапептиди пов’язані з ланцюгами C14-C17 β-аміножирних кислот (ланцюги можуть бути різними).У випадку екуріміцинів аміногрупа в β-положенні може утворювати амідний зв’язок із С-кінцем, таким чином утворюючи структуру макроциклічного лактаму.
Підклас фенгіцину містить фенгіцин А та В, які також називаються пліпастатином, якщо Tyr9 має D-конфігурацію.Декапептид пов'язаний з ланцюгом C14-C18 насиченої або ненасиченої β-гідроксижирної кислоти.Структурно пліпастатин також є макроциклічним лактоном, який містить бічний ланцюг Tyr у положенні 3 пептидної послідовності та утворює складноефірний зв’язок із C-кінцевим залишком, таким чином утворюючи внутрішню кільцеву структуру (як у випадку багатьох ліпопептидів Pseudomonas).
② Синтетична категорія ААС також можна синтезувати з використанням будь-якої кислотної, основної та нейтральної амінокислот.Загальними амінокислотами, які використовуються для синтезу ААС, є глутамінова кислота, серин, пролін, аспарагінова кислота, гліцин, аргінін, аланін, лейцин і білкові гідролізати.Цей підклас поверхнево-активних речовин можна отримати хімічним, ферментативним і хемоферментативним методами;однак для виробництва ААС більш економічно доцільним є хімічний синтез.Загальні приклади включають N-лауроіл-L-глутамінову кислоту та N-пальмітоїл-L-глутамінову кислоту.
|
4.2 На основі замісників аліфатичного ланцюга
Залежно від замісників аліфатичного ланцюга поверхнево-активні речовини на основі амінокислот можна розділити на 2 типи.
За положенням замісника
| ①N-заміщені ААС У N-заміщених сполуках аміногрупа замінюється на ліпофільну або карбоксильну групу, що призводить до втрати основності.найпростішим прикладом N-заміщених ААС є N-ациламінокислоти, які по суті є аніонними ПАР.n-заміщені ААС мають амідний зв'язок, приєднаний між гідрофобною та гідрофільною частинами.Амідний зв'язок має здатність утворювати водневий зв'язок, що полегшує деградацію цієї поверхнево-активної речовини в кислому середовищі, таким чином роблячи її біологічно розкладаною.
②C-заміщений ААС У С-заміщених сполуках заміщення відбувається за карбоксильною групою (через амідний чи складноефірний зв’язок).Типові C-заміщені сполуки (наприклад, складні ефіри або аміди) є по суті катіонними поверхнево-активними речовинами.
③N- та C-заміщені ААС У цьому типі поверхнево-активної речовини як аміногрупа, так і карбоксильна група є гідрофільною частиною.Цей тип по суті є амфотерним ПАР. |
4.3 За кількістю гідрофобних хвостів
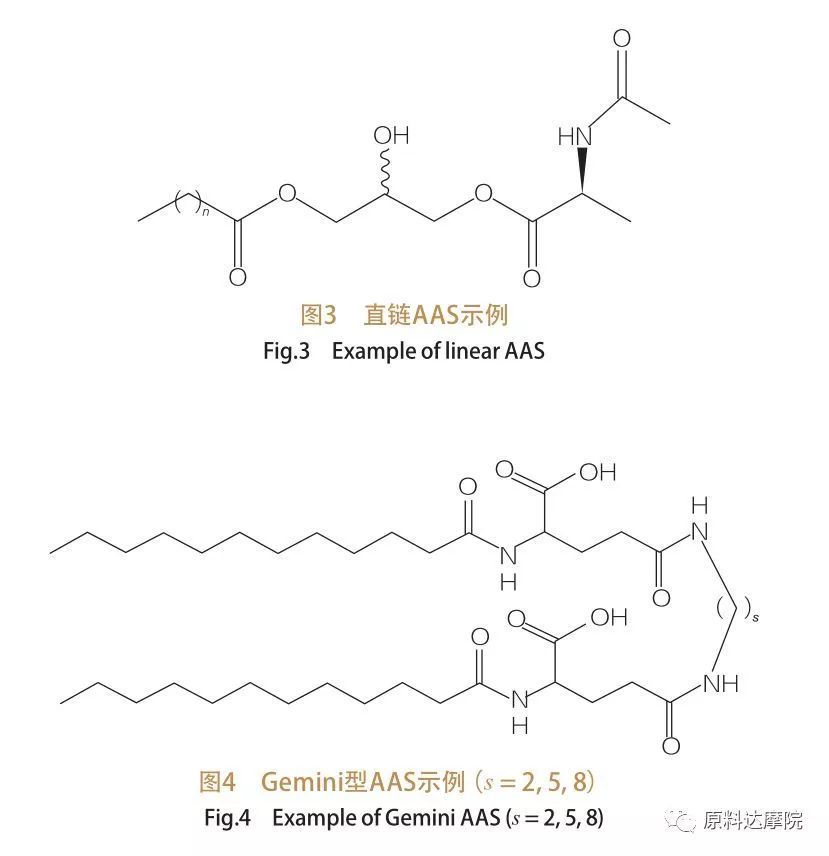
За кількістю головних груп і гідрофобних хвостів ААС можна розділити на чотири групи.ААС з прямим ланцюгом, ААС типу Джеміні (димер), ААС гліцероліпідного типу та біцефальний амфіфільний (Бола) ААС.поверхнево-активні речовини з прямим ланцюгом - це поверхнево-активні речовини, що складаються з амінокислот лише з одним гідрофобним хвостом (рис. 3).ААС типу Gemini мають дві амінокислотні полярні головні групи та два гідрофобні хвости на молекулу (рис. 4).У цьому типі структури дві прямоланцюгові ААС з’єднані між собою спейсером і тому також називаються димерами.У ААС гліцероліпідного типу, з іншого боку, два гідрофобні хвости приєднані до однієї амінокислотної головної групи.Ці поверхнево-активні речовини можна розглядати як аналоги моногліцеридів, дигліцеридів і фосфоліпідів, тоді як в ААС типу Бола дві головні групи амінокислот з'єднані гідрофобним хвостом.
4.4 За типом керівника групи
①Катіонна ААС
Головна група цього типу ПАР має позитивний заряд.Найпершим катіонним ААС є етилкокоіл аргінат, який є карбоксилатом піролідону.Унікальні та різноманітні властивості цієї поверхнево-активної речовини роблять її корисною в дезінфікуючих засобах, антимікробних засобах, антистатичних засобах, кондиціонерах для волосся, а також є м’якою для очей і шкіри та легкою біорозкладаністю.Сінгаре і Мхатре синтезували катіонні ААС на основі аргініну та оцінили їхні фізико-хімічні властивості.У цьому дослідженні вони заявили про високі виходи продуктів, отриманих в умовах реакції Шоттена-Баумана.Було виявлено, що зі збільшенням довжини алкільного ланцюга та гідрофобності поверхнева активність поверхнево-активної речовини зростає, а критична концентрація міцел (cmc) зменшується.Ще один четвертинний ацилпротеїн, який зазвичай використовується як кондиціонер у продуктах по догляду за волоссям.
②Аніонна ААС
В аніонних поверхнево-активних речовинах полярна головна група поверхнево-активної речовини має негативний заряд.Саркозин (CH 3 -NH-CH 2 -COOH, N-метилгліцин), амінокислота, яка зазвичай зустрічається в морських їжаках і морських зірках, хімічно споріднена гліцину (NH 2 -CH 2 -COOH), основної амінокислоти, знайденої в клітинах ссавців.-COOH,) хімічно споріднений гліцину, який є основною амінокислотою, що міститься в клітинах ссавців.Лауринова кислота, тетрадеканова кислота, олеїнова кислота та їх галогеніди та складні ефіри зазвичай використовуються для синтезу саркозинатних ПАР.Саркозинати за своєю природою є м’якими, тому їх зазвичай використовують у рідинах для полоскання рота, шампунях, пінах для гоління, сонцезахисних кремах, засобах для очищення шкіри та інших косметичних продуктах.
Інші комерційно доступні аніонні ААС включають Amisoft CS-22 і AmiliteGCK-12, які є торговими назвами N-кокоіл-L-глутамату натрію та N-кокоілгліцинату калію відповідно.Аміліт зазвичай використовується як піноутворювач, миючий засіб, солюбілізатор, емульгатор і диспергатор, і має багато застосувань у косметиці, наприклад, у шампунях, милах для ванн, миючих засобах для тіла, зубних пастах, миючих засобах для обличчя, миючих милах, очисниках для контактних лінз і побутових поверхнево-активних речовинах.Amisoft використовується як м’який засіб для очищення шкіри та волосся, головним чином у миючих засобах для обличчя та тіла, синтетичних миючих засобах, засобах для догляду за тілом, шампунях та інших продуктах для догляду за шкірою.
③цвіттеріонна або амфотерна ААС
Амфотерні поверхнево-активні речовини містять як кислотні, так і основні центри, тому можуть змінювати свій заряд, змінюючи значення pH.У лужному середовищі вони поводяться як аніонні ПАР, тоді як у кислому середовищі вони поводяться як катіонні ПАР, а в нейтральному середовищі як амфотерні ПАР.Лауриллізин (LL) і алкокси (2-гідроксипропіл)аргінін є єдиними відомими амфотерними поверхнево-активними речовинами на основі амінокислот.LL є продуктом конденсації лізину та лауринової кислоти.Завдяки своїй амфотерній структурі LL нерозчинний майже в усіх типах розчинників, за винятком дуже лужних або кислих розчинників.Як органічний порошок, LL має чудову адгезію до гідрофільних поверхонь і низький коефіцієнт тертя, що надає цій поверхнево-активній речовині чудову змащувальну здатність.LL широко використовується в кремах для шкіри та кондиціонерах для волосся, а також використовується як мастило.
④Неіонний ААС
Неіонні поверхнево-активні речовини характеризуються полярними головними групами без формальних зарядів.вісім нових етоксильованих неіоногенних поверхнево-активних речовин були отримані Al-Sabagh et al.з маслорозчинних α-амінокислот.У цьому процесі L-фенілаланін (LEP) і L-лейцин спочатку етерифікували гексадеканолом, а потім амідували пальмітиновою кислотою з отриманням двох амідів і двох складних ефірів α-амінокислот.Потім аміди та складні ефіри пройшли реакції конденсації з етиленоксидом для отримання трьох похідних фенілаланіну з різною кількістю поліоксиетиленових одиниць (40, 60 і 100).Було встановлено, що ці неіонні ААС мають хороші миючі та піноутворювальні властивості.
05 Синтез
5.1 Основний синтетичний шлях
У ААС гідрофобні групи можуть бути приєднані до амінних або карбонових кислот або через бічні ланцюги амінокислот.Виходячи з цього, доступні чотири основні синтетичні маршрути, як показано на малюнку 5.
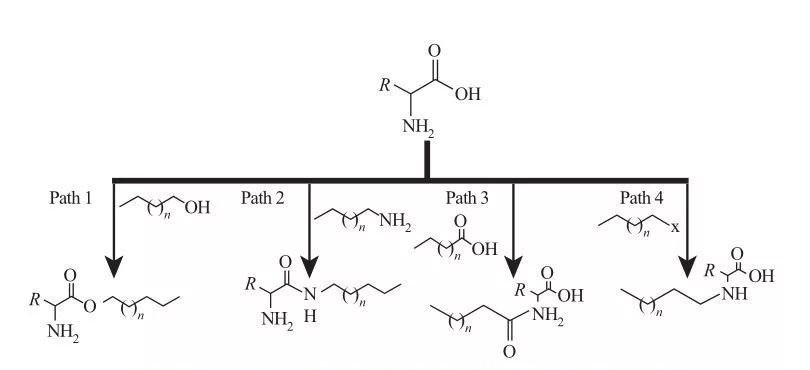
Рис.5 Фундаментальні шляхи синтезу поверхнево-активних речовин на основі амінокислот
| Шлях 1. Амфіфільні складні ефіри амінів отримують за допомогою реакцій етерифікації, у цьому випадку синтез поверхнево-активної речовини зазвичай досягається кип’ятінням жирних спиртів і амінокислот у присутності дегідрататора та кислотного каталізатора.У деяких реакціях сірчана кислота діє як каталізатор і дегідрататор.
Шлях 2. Активовані амінокислоти реагують з алкіламінами з утворенням амідних зв’язків, що призводить до синтезу амфіфільних амідоамінів.
Шлях 3. Амідокислоти синтезуються шляхом взаємодії аміногруп амінокислот з амідокислотами.
Шлях 4. Довголанцюгові алкіламінокислоти були синтезовані реакцією аміногрупи з галогеналканами. |
5.2 Досягнення в синтезі та виробництві
5.2.1 Синтез поверхнево-активних речовин з одноланцюговою амінокислотою/пептидом
N-ацил- або О-ацил-амінокислоти або пептиди можуть бути синтезовані ферментативно-каталізованим ацилюванням амінних або гідроксильних груп жирними кислотами.У першому звіті про каталізований ліпазою синтез без розчинників похідних аміду або метилового ефіру амінокислоти використовувався Candida antarctica з виходом від 25% до 90% залежно від цільової амінокислоти.Метилетилкетон також використовувався як розчинник у деяких реакціях.Vonderhagen та ін.також описані каталізовані ліпазою та протеазою реакції N-ацилювання амінокислот, білкових гідролізатів та/або їх похідних з використанням суміші води та органічних розчинників (наприклад, диметилформамід/вода) та метилбутилкетону.
На початку основною проблемою каталізованого ферментами синтезу ААС були низькі врожаї.За даними Valivety et al.вихід похідних N-тетрадеканоїл амінокислоти становив лише 2%-10% навіть після використання різних ліпаз та інкубації при 70°C протягом багатьох днів.Монте та ін.також зіткнулися з проблемами, пов'язаними з низьким виходом амінокислот при синтезі N-ациллізину з використанням жирних кислот і рослинних олій.Згідно з ними, максимальний вихід продукту склав 19% в умовах без розчинників і з використанням органічних розчинників.з такою ж проблемою зіткнулися Valivety та ін.у синтезі похідних метилового ефіру N-Cbz-L-лізину або N-Cbz-лізину.
У цьому дослідженні вони стверджували, що вихід 3-O-тетрадеканоїл-L-серину становив 80% при використанні N-захищеного серину як субстрату та Novozyme 435 як каталізатора в розплавленому середовищі без розчинників.Нагао та Кіто досліджували O-ацилювання L-серину, L-гомосерину, L-треоніну та L-тирозину (LET) при використанні ліпази. Результати реакції (ліпаза була отримана Candida cylindracea та Rhizopus delemar у водному буферному середовищі) і повідомили, що вихід ацилювання L-гомосерину та L-серину був дещо низьким, тоді як ацилювання L-треоніну та LET не відбувалося.
Багато дослідників підтримують використання недорогих і легкодоступних субстратів для синтезу економічно ефективних ААС.Су та ін.стверджував, що приготування поверхнево-активних речовин на основі пальмової олії найкраще працює з іммобілізованим ліпоферментом.Вони відзначили, що вихід продуктів буде кращим, незважаючи на тривалу реакцію (6 днів).Герова та ін.досліджували синтез і поверхневу активність хіральної N-пальмітоїлової ААС на основі метіоніну, проліну, лейцину, треоніну, фенілаланіну та фенілгліцину в циклічній/рацемічній суміші.Панг і Чу описали синтез мономерів на основі амінокислот і мономерів на основі дикарбонової кислоти в розчині Ряд функціональних і біологічно розкладаних поліамідних ефірів на основі амінокислот було синтезовано за допомогою реакцій спільної конденсації в розчині.
Cantaeuzene і Guerreiro повідомили про етерифікацію груп карбонової кислоти Boc-Ala-OH і Boc-Asp-OH за допомогою довголанцюгових аліфатичних спиртів і діолів, з дихлорметаном як розчинником і агарозою 4B (Sepharose 4B) як каталізатором.У цьому дослідженні реакція Boc-Ala-OH з жирними спиртами до 16 атомів вуглецю дала хороші виходи (51%), тоді як для Boc-Asp-OH 6 і 12 атомів вуглецю були кращими, з відповідним виходом 63% [64]. ].99,9%) з виходами в діапазоні від 58% до 76%, які були синтезовані шляхом утворення амідних зв’язків з різними довголанцюговими алкіламінами або складноефірних зв’язків з жирними спиртами за допомогою Cbz-Arg-OMe, де папаїн діяв як каталізатор.
5.2.2 Синтез амінокислотних/пептидних поверхнево-активних речовин на основі Gemini
Поверхнево-активні речовини Gemini на основі амінокислот складаються з двох молекул AAS з прямим ланцюгом, з’єднаних одна з одною спейсерною групою.Існують 2 можливі схеми хемоферментного синтезу поверхнево-активних речовин на основі амінокислот геміні типу (рис. 6 і 7).На малюнку 6 2 похідні амінокислоти реагують із сполукою як спейсерною групою, а потім вводяться 2 гідрофобні групи.На малюнку 7 2 прямоланцюгові структури безпосередньо з’єднані між собою біфункціональною спейсерною групою.
Найбільш рання розробка ферментативно-каталізованого синтезу ліпоамінокислот Gemini була започаткована Valivety та ін.Yoshimura та ін.досліджували синтез, адсорбцію та агрегацію поверхнево-активної речовини Gemini на основі амінокислот на основі цистину та n-алкілброміду.Синтезовані ПАР порівнювали з відповідними мономерними ПАР.Фаустіно та ін.описав синтез аніонних мономерних ААС на основі сечовини на основі L-цистину, D-цистину, DL-цистину, L-цистеїну, L-метіоніну та L-сульфоаланіну та їх пар геміні за допомогою провідності, рівноважного поверхневого натягу та стійкого - характеристика їх стану флуоресценції.Було показано, що значення cmc Gemini було нижчим, порівнюючи мономер і Gemini.
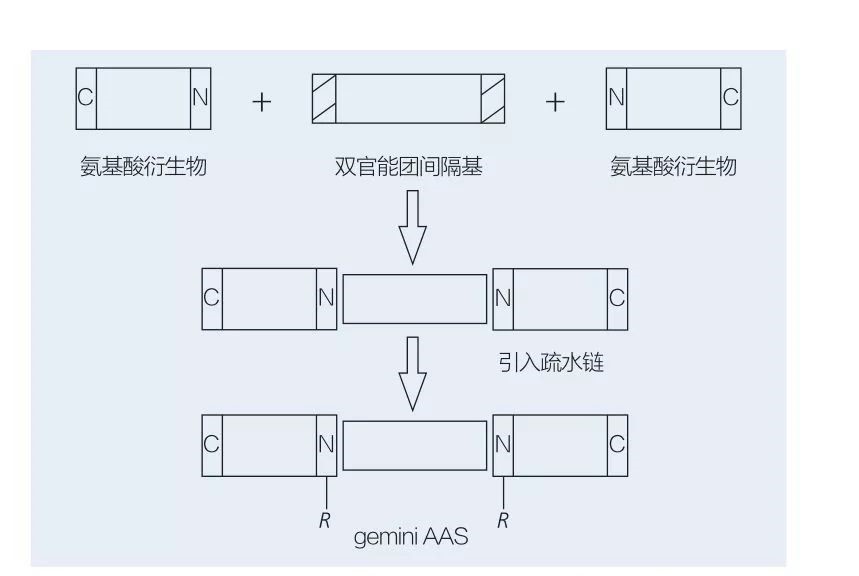
Рис.6 Синтез gemini AAS з використанням похідних AA та спейсера з подальшим введенням гідрофобної групи
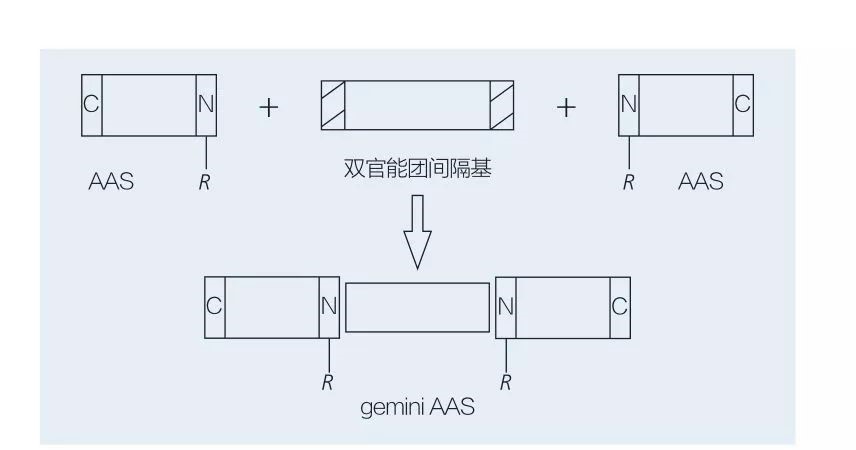
Рис.7 Синтез ААС Gemini з використанням біфункціонального спейсера та ААС
5.2.3 Синтез гліцероліпідних амінокислотних/пептидних поверхнево-активних речовин
Гліцероліпідні амінокислоти/пептидні поверхнево-активні речовини – це новий клас ліпідних амінокислот, які є структурними аналогами моно- (або ді-) ефірів і фосфоліпідів гліцерину завдяки своїй структурі з одного або двох жирових ланцюгів з однією амінокислотою, пов’язаною з гліцериновим скелетом. складноефірним зв'язком.Синтез цих поверхнево-активних речовин починається з отримання гліцеринових ефірів амінокислот при підвищених температурах і в присутності кислотного каталізатора (наприклад, BF 3).Ферментно-каталізований синтез (з використанням гідролаз, протеаз і ліпаз як каталізаторів) також є хорошим варіантом (рис. 8).
Повідомлялося про каталізований ферментами синтез кон'югатів дилаурилованих гліцеридів аргініну з використанням папаїну.Також повідомлялося про синтез кон’югатів діацилгліцеринового ефіру з ацетиларгініну та оцінку їх фізико-хімічних властивостей.
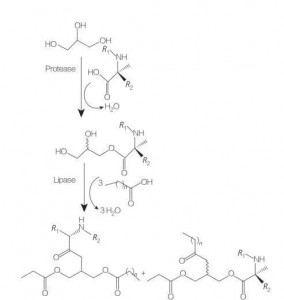
Рис.8 Синтез моно- та діацилгліцеринових амінокислотних кон’югатів
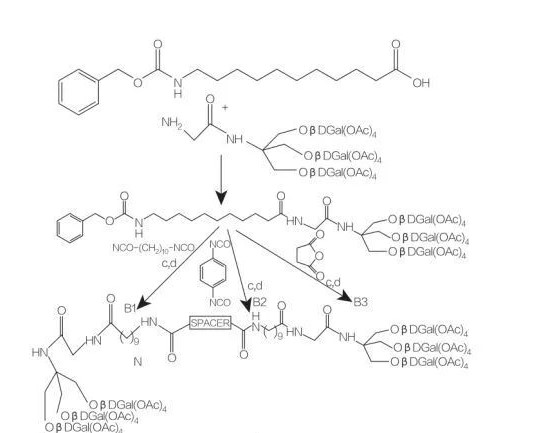
прокладка: NH-(CH2)10-NH: сполука B1
прокладка: NH-C6H4-NH: сполука B2
розпірка: CH2-CH2: сполука B3
Рис.9 Синтез симетричних амфіфілів, отриманих з трис(гідроксиметил)амінометану
5.2.4 Синтез амінокислотних/пептидних поверхнево-активних речовин на основі бола
Амфіфіли типу бола на основі амінокислот містять 2 амінокислоти, які пов’язані з одним гідрофобним ланцюгом.Franceschi та ін.описав синтез амфіфілів типу бола з 2 амінокислотами (D- або L-аланіном або L-гістидином) і 1 алкільним ланцюгом різної довжини та дослідив їх поверхневу активність.Вони обговорюють синтез і агрегацію нових амфіфілів типу бола з амінокислотною фракцією (з використанням незвичайної β-амінокислоти або спирту) і спейсерною групою C12-C20.Незвичайними β-амінокислотами, що використовуються, можуть бути цукрова амінокислота, амінокислота, похідна від азидотиміну (AZT), амінокислота норборнену та аміноспирт, похідний від AZT (рис. 9).синтез симетричних амфіфілів типу бола, отриманих з трис(гідроксиметил)амінометану (Тріс) (рис. 9).
06 Фізико-хімічні властивості
Добре відомо, що поверхнево-активні речовини на основі амінокислот (AAS) є різноманітними та універсальними за своєю природою та мають хорошу застосовність у багатьох сферах застосування, таких як хороша солюбілізація, хороші властивості емульгування, висока ефективність, висока поверхнева активність та хороша стійкість до жорсткої води (іони кальцію). толерантність).
На підставі поверхнево-активних властивостей амінокислот (наприклад, поверхневий натяг, смс, фазова поведінка та температура Крафта) після обширних досліджень було зроблено наступні висновки: поверхнева активність AAS перевершує активність його звичайного поверхнево-активного аналога.
6.1 Критична концентрація міцел (cmc)
Критична концентрація міцел є одним із важливих параметрів поверхнево-активних речовин і визначає багато поверхнево-активних властивостей, таких як солюбілізація, лізис клітин та їх взаємодія з біоплівками тощо. Загалом збільшення довжини ланцюга вуглеводневого хвоста (збільшення гідрофобності) призводить до зменшення у значенні смс розчину поверхнево-активної речовини, таким чином підвищуючи його поверхневу активність.Поверхнево-активні речовини на основі амінокислот зазвичай мають нижчі значення смс порівняно зі звичайними поверхнево-активними речовинами.
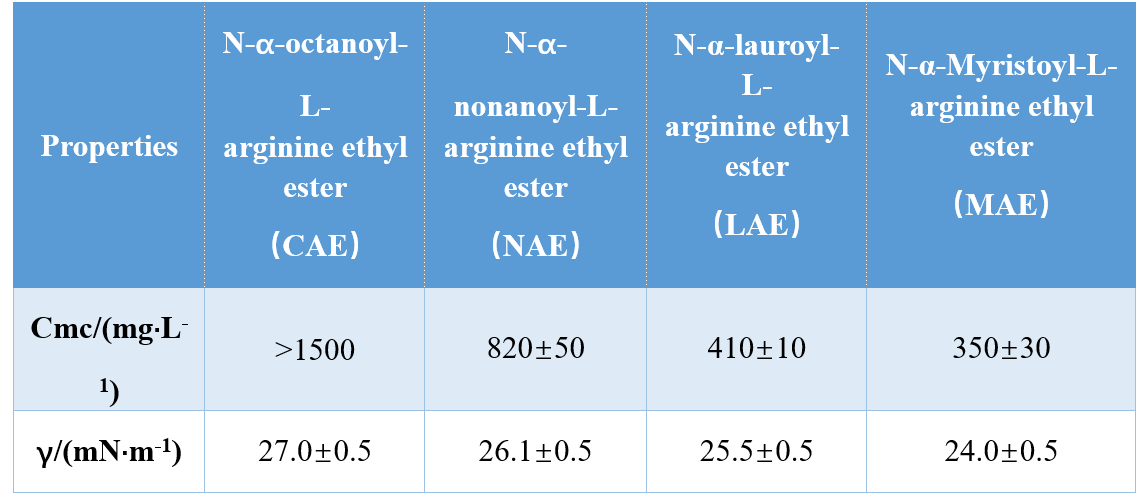
За допомогою різних комбінацій головних груп і гідрофобних хвостів (монокатіонний амід, бікатіонний амід, бікатіонний складний ефір на основі аміду), Infante et al.синтезували три AAS на основі аргініну та вивчили їх cmc і γcmc (поверхневий натяг при cmc), показавши, що значення cmc і γcmc зменшуються зі збільшенням довжини гідрофобного хвоста.В іншому дослідженні Singare і Mhatre виявили, що CMC поверхнево-активних речовин N-α-ациларгініну зменшується зі збільшенням кількості гідрофобних хвостових атомів вуглецю (таблиця 1).
Yoshimura та ін.досліджували ККМ поверхнево-активних речовин Gemini на основі амінокислот, отриманих із цистеїну, і показали, що ККМ зменшується, коли довжину вуглецевого ланцюга в гідрофобному ланцюзі збільшують з 10 до 12. Подальше збільшення довжини вуглецевого ланцюга до 14 призводить до збільшення ККМ, який підтвердив, що довголанцюгові поверхнево-активні речовини Gemini мають меншу тенденцію до агрегації.
Фаустіно та ін.повідомили про утворення змішаних міцел у водних розчинах аніонних геміні ПАР на основі цистину.Поверхнево-активні речовини Gemini також порівнювали з відповідними звичайними мономерними поверхнево-активними речовинами (C 8 Cys).Повідомлялося, що значення cmc сумішей ліпідів і поверхнево-активних речовин нижчі, ніж у чистих поверхнево-активних речовин.поверхнево-активні речовини Gemini та 1,2-дигептаноїл-sn-гліцерил-3-фосфохолін, водорозчинний міцелоутворюючий фосфоліпід, мали ККМ на мілімолярному рівні.
Шреста та Арамакі досліджували утворення в’язкопружних червоподібних міцел у водних розчинах аніонно-неіонних поверхнево-активних речовин на основі змішаних амінокислот за відсутності домішок солей.У цьому дослідженні було виявлено, що N-додецилглутамат має вищу температуру Крафта;однак при нейтралізації основною амінокислотою L-лізином утворилися міцели, і розчин почав поводитися як ньютонівська рідина при 25 °C.
6.2 Хороша розчинність у воді
Хороша розчинність ААС у воді зумовлена наявністю додаткових зв’язків CO-NH.Це робить ААС більш біологічно розкладаним і екологічно чистим, ніж відповідні звичайні поверхнево-активні речовини.Розчинність у воді N-ацил-L-глутамінової кислоти ще краща завдяки її 2 карбоксильним групам.Розчинність у воді Cn(CA) 2 також хороша, оскільки в 1 молекулі є 2 іонні групи аргініну, що призводить до більш ефективної адсорбції та дифузії на межі клітинної поверхні та навіть ефективного інгібування бактерій при нижчих концентраціях.
6.3 Температура Крафта і точка Крафта
Температуру Крафта можна розуміти як специфічну поведінку розчинності поверхнево-активних речовин, розчинність яких різко зростає вище певної температури.Іонні поверхнево-активні речовини мають тенденцію утворювати тверді гідрати, які можуть випадати в осад із води.При певній температурі (так званій температурі Крафта) зазвичай спостерігається різке і непостійне збільшення розчинності поверхнево-активних речовин.Точка Крафта іонної поверхнево-активної речовини - це температура Крафта при смс.
Ця характеристика розчинності зазвичай спостерігається для іоногенних поверхнево-активних речовин і може бути пояснена наступним чином: розчинність мономеру, що не містить поверхнево-активної речовини, обмежена нижче температури Крафта, доки не буде досягнуто точки Крафта, де його розчинність поступово зростає через утворення міцел.Для забезпечення повної розчинності необхідно готувати склади поверхнево-активних речовин при температурах вище точки Крафта.
Температуру Крафта AAS було вивчено та порівняно з температурою звичайних синтетичних поверхнево-активних речовин. Шреста та Арамакі вивчили температуру Крафта AAS на основі аргініну та виявили, що критична концентрація міцел демонструє агрегаційну поведінку у формі преміцел вище 2-5 ×10-6 моль-л -1 з подальшим утворенням нормальної міцели (Ohta та ін. синтезували шість різних типів N-гексадеканоїлових AAS і обговорили зв’язок між їх температурою Краффта та амінокислотними залишками.
В експериментах було виявлено, що температура Крафта N-гексадеканоїлової ААС зростає зі зменшенням розміру амінокислотних залишків (виняток становить фенілаланін), а теплота розчинності (поглинання тепла) зростає зі зменшенням розміру амінокислотних залишків (з за винятком гліцину та фенілаланіну).Було зроблено висновок, що як у системах аланіну, так і в системах фенілаланіну DL-взаємодія є сильнішою, ніж LL-взаємодія у твердій формі N-гексадеканоїлової солі AAS.
Бріто та ін.визначив температуру Краффта трьох серій нових поверхнево-активних речовин на основі амінокислот за допомогою диференціальної скануючої мікрокалориметрії та виявив, що зміна трифторацетат-іона на йодид-іон призвела до значного підвищення температури Краффта (приблизно на 6 °C) з 47 °C до 53 °C. C.Наявність цис-подвійних зв'язків і ненасиченості, наявні в довголанцюгових Ser-похідних, призвели до значного зниження температури Краффта.Повідомлялося, що н-додецилглутамат має вищу температуру Крафта.Однак нейтралізація основною амінокислотою L-лізином призвела до утворення міцел у розчині, які поводилися як ньютонівські рідини при 25 °C.
6.4 Поверхневий натяг
Поверхневий натяг поверхнево-активних речовин пов'язаний з довжиною ланцюга гідрофобної частини.Чжан та ін.визначили поверхневий натяг кокоілгліцинату натрію методом пластинки Вільгельмі (25±0,2)°C і визначили значення поверхневого натягу при cmc як 33 мН-м -1 , cmc як 0,21 ммоль-л -1.Yoshimura та ін.визначали поверхневий натяг поверхнево-активних речовин на основі 2C n Cys на основі амінокислоти типу 2C n Cys.Було виявлено, що поверхневий натяг при cmc зменшувався зі збільшенням довжини ланцюга (до n = 8), тоді як тенденція була протилежною для поверхнево-активних речовин з n = 12 або більшою довжиною ланцюга.
Досліджено також вплив СаС1 2 на поверхневий натяг ПАР на основі дикарбоксильованих амінокислот.У цих дослідженнях CaCl 2 додавали до водних розчинів трьох поверхнево-активних речовин типу дикарбоксилованих амінокислот (C12 MalNa 2, C12 AspNa 2 і C12 GluNa 2).Порівняли значення плато після cmc і виявили, що поверхневий натяг зменшується при дуже низьких концентраціях CaC1 2.Це пов'язано з впливом іонів кальцію на розташування поверхнево-активної речовини на межі газ-вода.поверхневий натяг солей N-додециламіномалонату та N-додециласпартату, з іншого боку, також був майже постійним до концентрації 10 ммоль-л -1 CaCl 2 .Вище 10 ммоль-л -1 поверхневий натяг різко зростає внаслідок утворення осаду кальцієвої солі ПАР.Для динатрієвої солі N-додецилглутамату помірне додавання CaC1 2 призвело до значного зниження поверхневого натягу, тоді як продовжене збільшення концентрації CaC1 2 більше не викликало значних змін.
Для визначення кінетики адсорбції ААС типу gemini на межі газ-вода визначали динамічний поверхневий натяг методом максимального тиску бульбашки.Результати показали, що протягом найдовшого часу випробування динамічний поверхневий натяг 2C 12 Cys не змінився.Зменшення динамічного поверхневого натягу залежить лише від концентрації, довжини гідрофобних хвостів і кількості гідрофобних хвостів.Збільшення концентрації поверхнево-активної речовини, зменшення довжини ланцюга, а також кількості ланцюгів призвели до більш швидкого розпаду.Результати, отримані для більш високих концентрацій C n Cys (n = 8 до 12), виявилися дуже близькими до γ cmc, виміряного методом Вільгельмі.
В іншому дослідженні динамічний поверхневий натяг дилаурилцистину натрію (SDLC) і дидекаміноцистину натрію визначали методом пластинки Вільгельмі, а крім того, рівноважний поверхневий натяг їхніх водних розчинів визначали методом об’єму краплі.Реакцію дисульфідних зв'язків досліджували й іншими методами.Додавання меркаптоетанолу до 0,1 ммоль-л розчину -1SDLC призвело до швидкого збільшення поверхневого натягу з 34 мН-м -1 до 53 мН-м -1 .Оскільки NaClO може окислювати дисульфідні зв’язки SDLC до груп сульфонової кислоти, при додаванні NaClO (5 ммоль-л-1) до 0,1 ммоль-л-1 розчину SDLC не спостерігалося жодних агрегатів.Результати просвічуючої електронної мікроскопії та динамічного розсіювання світла показали, що в розчині не утворилися агрегати.Було виявлено, що поверхневий натяг SDLC зростає з 34 мН-м -1 до 60 мН-м -1 протягом 20 хвилин.
6.5 Бінарні поверхневі взаємодії
У науках про життя ряд груп вивчали вібраційні властивості сумішей катіонних AAS (поверхнево-активних речовин на основі діацилгліцероларгініну) і фосфоліпідів на межі газ-вода, зрештою дійшовши висновку, що ця неідеальна властивість спричиняє переважання електростатичних взаємодій.
6.6 Агрегаційні властивості
Динамічне розсіювання світла зазвичай використовується для визначення агрегаційних властивостей мономерів на основі амінокислот і геміні поверхнево-активних речовин у концентраціях вище cmc, що дає уявний гідродинамічний діаметр DH (= 2R H ).Агрегати, утворені C n Cys і 2Cn Cys, є відносно великими та мають широкий розподіл порівняно з іншими поверхнево-активними речовинами.Усі поверхнево-активні речовини, крім 2C 12 Cys, зазвичай утворюють агрегати приблизно 10 нм.Розміри міцел поверхнево-активних речовин Gemini значно більші, ніж у їх мономерних аналогів.Збільшення довжини вуглеводневого ланцюга також призводить до збільшення розміру міцел.охта та ін.описав властивості агрегації трьох різних стереоізомерів N-додецил-фенілаланіл-феніланіну тетраметиламонію у водному розчині та показав, що діастереоізомери мають однакову критичну концентрацію агрегації у водному розчині.Івахасі та ін.Досліджено за допомогою кругового дихроїзму, ЯМР та осмометрії тиску пари. Утворення хіральних агрегатів N-додеканоїл-L-глутамінової кислоти, N-додеканоїл-L-валіну та їх метилових ефірів у різних розчинниках (таких як тетрагідрофуран, ацетонітрил, 1,4 -діоксану та 1,2-дихлоретану) з обертальними властивостями досліджували за допомогою кругового дихроїзму, ЯМР та осмометрії тиску пари.
6.7 Міжфазна адсорбція
Одним із напрямів досліджень також є міжфазна адсорбція поверхнево-активних речовин на основі амінокислот та її порівняння зі звичайним аналогом.Наприклад, досліджено межфазові адсорбційні властивості додецилових ефірів ароматичних амінокислот, отриманих з LET і LEP.Результати показали, що LET і LEP демонструють нижчі міжфазні площі на межі розділу газ-рідина та на межі розділу вода/гексан відповідно.
Bordes та ін.досліджували поведінку розчину та адсорбцію на межі газ-вода трьох дикарбоксилованих амінокислотних поверхнево-активних речовин, динатрієвих солей додецилглутамату, додециласпартату та аміномалонату (з 3, 2 та 1 атомами вуглецю між двома карбоксильними групами відповідно).Відповідно до цього звіту, CMC дикарбоксильованих поверхнево-активних речовин була в 4-5 разів вищою, ніж у монокарбоксильованої солі додецилгліцину.Це пояснюється утворенням водневих зв’язків між дикарбоксильованими поверхнево-активними речовинами та сусідніми молекулами через амідні групи в них.
6.8 Фазова поведінка
Ізотропні розривні кубічні фази спостерігаються для поверхнево-активних речовин при дуже високих концентраціях.Молекули поверхнево-активної речовини з дуже великими головними групами прагнуть утворювати агрегати меншої позитивної кривизни.Маркес та ін.досліджували фазову поведінку систем 12Lys12/12Ser і 8Lys8/16Ser (див. рис. 10), і результати показали, що система 12Lys12/12Ser має зону поділу фаз між областями міцелярного та везикулярного розчину, тоді як система 8Lys8/16Ser Система 8Lys8/16Ser демонструє безперервний перехід (видовжена область міцелярної фази між малою областю міцелярної фази та областю фази везикули).Слід зазначити, що для області везикул системи 12Lys12/12Ser везикули завжди співіснують з міцелами, тоді як область везикул системи 8Lys8/16Ser має лише везикули.
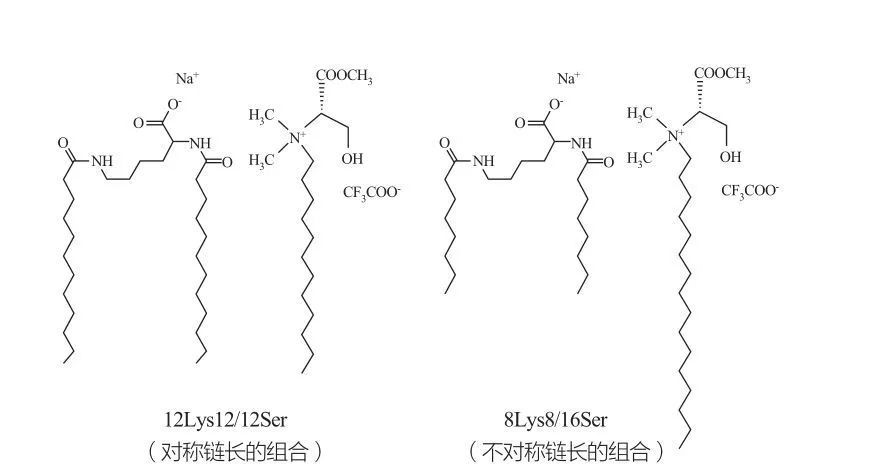
Катаніонні суміші поверхнево-активних речовин на основі лізину та серину: симетрична пара 12Lys12/12Ser (ліворуч) та асиметрична пара 8Lys8/16Ser (праворуч)
6.9 Емульгуюча здатність
Коучі та ін.досліджували емульгуючу здатність, міжфазний натяг, здатність до диспергування та в’язкість N-[3-додецил-2-гідроксипропіл]-L-аргініну, L-глутамату та інших ААС.У порівнянні з синтетичними поверхнево-активними речовинами (їх звичайними неіонними та амфотерними аналогами) результати показали, що ААС мають сильнішу емульгуючу здатність, ніж звичайні поверхнево-активні речовини.
Бачко та ін.синтезував нові аніонні амінокислотні поверхнево-активні речовини та досліджував їх придатність як хірально орієнтованих розчинників ЯМР-спектроскопії.Ряд амфіфільних похідних L-Phe або L-Ala на основі сульфонату з різними гідрофобними хвостами (пентил~тетрадецил) були синтезовані шляхом взаємодії амінокислот з о-сульфобензойним ангідридом.Ву та ін.синтезовані натрієві солі N-жирного ацилу ААС ідосліджували їхню здатність до емульгування в емульсіях «олія-у-воді», і результати показали, що ці поверхнево-активні речовини працюють краще з етилацетатом як масляною фазою, ніж з н-гексаном як масляною фазою.
6.10 Досягнення в синтезі та виробництві
Стійкість до жорсткої води можна розуміти як здатність поверхнево-активних речовин протистояти присутності таких іонів, як кальцій і магній, у жорсткій воді, тобто здатність уникати осадження кальцієвого мила.Поверхнево-активні речовини з високою стійкістю до жорсткої води дуже корисні для складів миючих засобів і засобів особистої гігієни.Стійкість до жорсткої води можна оцінити шляхом розрахунку зміни розчинності та поверхневої активності поверхнево-активної речовини в присутності іонів кальцію.
Іншим способом оцінки стійкості до жорсткої води є обчислення відсотка або грамів поверхнево-активної речовини, необхідних для диспергування у воді кальцієвого мила з 100 г олеату натрію.У регіонах із високою жорсткістю води висока концентрація іонів кальцію та магнію та вміст мінералів може ускладнити деякі практичні застосування.Часто іон натрію використовують як протиіон синтетичного аніонного ПАР.Оскільки двовалентний іон кальцію зв’язаний з обома молекулами поверхнево-активної речовини, він змушує поверхнево-активну речовину легше випадати в осад із розчину, що зменшує ймовірність мийної дії.
Дослідження стійкості AAS до жорсткої води показало, що на кислотостійкість і стійкість до жорсткої води сильно впливає додаткова карбоксильна група, а кислотостійкість і стійкість до жорсткої води зростає ще більше зі збільшенням довжини спейсерної групи між двома карбоксильними групами. .Порядок стійкості до кислоти та жорсткої води був C 12 гліцинат < C 12 аспартат < C 12 глутамат.Порівнюючи дикарбоксильований амідний зв’язок і дикарбоксильований аміно-ПАР відповідно, було виявлено, що діапазон рН останнього був ширшим, а його поверхнева активність зросла з додаванням відповідної кількості кислоти.Дикарбоксильовані N-алкіл-амінокислоти показали хелатуючий ефект у присутності іонів кальцію, і C 12 аспартат утворив білий гель.c 12 глутамат показав високу поверхневу активність при високій концентрації Ca 2+ і, як очікується, буде використовуватися для опріснення морської води.
6.11 Розсіюваність
Дисперсність відноситься до здатності поверхнево-активної речовини запобігати коалесценції та осіданню поверхнево-активної речовини в розчині.Дисперсійність є важливою властивістю поверхнево-активних речовин, яка робить їх придатними для використання в миючих засобах, косметиці та фармацевтиці.Диспергуюча речовина повинна містити складноефірний, ефірний, амідний або амінозв’язок між гідрофобною групою та кінцевою гідрофільною групою (або між гідрофобними групами з прямим ланцюгом).
Як правило, аніонні поверхнево-активні речовини, такі як алканоламідосульфати, і амфотерні поверхнево-активні речовини, такі як амідосульфобетаїн, особливо ефективні як диспергуючі агенти для кальцієвих мил.
Багато дослідницьких зусиль визначили здатність до диспергування AAS, де було виявлено, що N-лауроїллізин погано сумісний з водою і його важко використовувати для косметичних рецептур.У цій серії N-ацилзаміщені основні амінокислоти мають чудову здатність до диспергування та використовуються в косметичній промисловості для покращення рецептур.
07 Токсичність
Звичайні ПАР, особливо катіонні ПАР, дуже токсичні для водних організмів.Їх гостра токсичність зумовлена явищем адсорбційно-іонної взаємодії поверхнево-активних речовин на межі клітина-вода.Зниження ККМ ПАР зазвичай призводить до посилення міжфазної адсорбції ПАР, що зазвичай призводить до їх підвищеної гострої токсичності.Збільшення довжини гідрофобного ланцюга ПАР також призводить до підвищення гострої токсичності ПАР.Більшість ААС мають низький вміст або нетоксичні для людини та навколишнього середовища (особливо для морських організмів) і придатні для використання в якості харчових інгредієнтів, фармацевтичних препаратів і косметики.Багато дослідників показали, що поверхнево-активні речовини амінокислот м’які та не подразнюють шкіру.Відомо, що поверхнево-активні речовини на основі аргініну менш токсичні, ніж їх звичайні аналоги.
Бріто та ін.вивчав фізико-хімічні та токсикологічні властивості амфіфілів на основі амінокислот та їх [похідних тирозину (Tyr), гідроксипроліну (Hyp), серину (Ser) і лізину (Lys)] спонтанного утворення катіонних везикул і надав дані про їхню гостру токсичність для Daphnia magna (IC 50).Вони синтезували катіонні везикули броміду додецилтриметиламонію (DTAB)/Lys-похідних та/або сумішей Ser-/Lys-похідних і перевірили їхню екотоксичність і гемолітичний потенціал, показавши, що всі AAS та їх суміші, що містять везикули, менш токсичні, ніж звичайна поверхнево-активна речовина DTAB. .
Роза та ін.досліджував зв’язування (асоціацію) ДНК зі стабільними катіонними везикулами на основі амінокислот.На відміну від звичайних катіонних поверхнево-активних речовин, які часто виявляються токсичними, взаємодія катіонних амінокислотних поверхнево-активних речовин виявляється нетоксичною.Катіонна ААС заснована на аргініні, який спонтанно утворює стабільні везикули в поєднанні з певними аніонними поверхнево-активними речовинами.Інгібітори корозії на основі амінокислот також вважаються нетоксичними.Ці поверхнево-активні речовини легко синтезуються з високою чистотою (до 99%), мають низьку вартість, легко біологічно розкладаються та повністю розчиняються у водному середовищі.Кілька досліджень показали, що сірковмісні амінокислотні поверхнево-активні речовини є кращими в інгібуванні корозії.
У недавньому дослідженні Perinelli та ін.повідомили про задовільний токсикологічний профіль рамноліпідів порівняно зі звичайними поверхнево-активними речовинами.Відомо, що рамноліпіди діють як підсилювачі проникності.Вони також повідомили про вплив рамноліпідів на епітеліальну проникність високомолекулярних препаратів.
08 Антимікробна активність
Протимікробну активність ПАР можна оцінити за мінімальною інгібіторною концентрацією.Детально вивчено антимікробну дію ПАР на основі аргініну.Грамнегативні бактерії виявилися більш стійкими до поверхнево-активних речовин на основі аргініну, ніж грампозитивні бактерії.Антимікробна активність поверхнево-активних речовин зазвичай підвищується завдяки наявності гідроксильних, циклопропанових або ненасичених зв’язків у ацильних ланцюгах.Кастільо та ін.показали, що довжина ацильних ланцюгів і позитивний заряд визначають значення ГЛБ (гідрофільно-ліпофільний баланс) молекули, і це дійсно впливає на їхню здатність руйнувати мембрани.Метиловий ефір Nα-ациларгініну є ще одним важливим класом катіонних поверхнево-активних речовин із широким спектром антимікробної дії, він легко розкладається біологічно та має низьку токсичність або зовсім не токсичний.Дослідження взаємодії поверхнево-активних речовин на основі метилового ефіру Nα-ациларгініну з 1,2-дипальмітоїл-sn-пропілтріоксил-3-фосфорилхоліном та 1,2-дітетрадеканоїл-sn-пропілтріоксил-3-фосфорилхоліном, модельними мембранами та живими організмами в наявність або відсутність зовнішніх бар'єрів показали, що цей клас поверхнево-активних речовин має гарну антимікробну дію. Результати показали, що поверхнево-активні речовини мають хорошу антибактеріальну активність.
09 Реологічні властивості
Реологічні властивості поверхнево-активних речовин відіграють дуже важливу роль у визначенні та прогнозуванні їх застосування в різних галузях промисловості, включаючи харчову, фармацевтичну, нафтовидобувну, засоби особистої гігієни та засоби догляду за домом.Було проведено багато досліджень для обговорення зв’язку між в’язкопружністю поверхнево-активних речовин амінокислот і смс.
10 Застосування в косметичній промисловості
ААС використовуються у складі багатьох засобів особистої гігієни.Встановлено, що N-кокоілгліцинат калію м’який для шкіри та використовується для очищення обличчя для видалення забруднень і макіяжу.н-Ацил-L-глутамінова кислота має дві карбоксильні групи, що робить її більш розчинною у воді.Серед цих ААС, ААС на основі C 12 жирних кислот широко використовуються в очищенні обличчя для видалення шлаку та макіяжу.ААС із ланцюгом C 18 використовуються як емульгатори в продуктах по догляду за шкірою, а солі N-лаурилаланіну, як відомо, створюють кремоподібну піну, яка не подразнює шкіру, тому їх можна використовувати у складі засобів по догляду за немовлятами.ААС на основі N-лаурилу, які використовуються в зубній пасті, мають хороші миючі властивості, подібні до мила, і сильну ефективність інгібування ферментів.
Протягом останніх кількох десятиліть вибір поверхнево-активних речовин для косметики, засобів особистої гігієни та фармацевтичних препаратів зосереджувався на низькій токсичності, м’якості, ніжності на дотик і безпеці.Споживачі цих продуктів чітко усвідомлюють потенційне подразнення, токсичність і фактори навколишнього середовища.
Сьогодні ААС використовується для виготовлення багатьох шампунів, фарб для волосся та мила для ванн завдяки їхнім багатьом перевагам перед традиційними аналогами в косметиці та засобах особистої гігієни.Поверхнево-активні речовини на білковій основі мають бажані властивості, необхідні для засобів особистої гігієни.Деякі AAS мають здатність до плівкоутворення, тоді як інші мають гарну здатність до спінювання.
Амінокислоти є важливими природними факторами зволоження рогового шару.Коли клітини епідермісу гинуть, вони стають частиною рогового шару, а внутрішньоклітинні білки поступово розкладаються до амінокислот.Ці амінокислоти потім транспортуються далі в роговий шар, де вони поглинають жир або жироподібні речовини в епідермальний роговий шар, тим самим покращуючи еластичність поверхні шкіри.Приблизно 50% природного зволожуючого фактора шкіри складається з амінокислот і піролідону.
Колаген, поширений косметичний інгредієнт, також містить амінокислоти, які зберігають шкіру м'якою.Такі проблеми зі шкірою, як шорсткість і тьмяність, здебільшого викликані нестачею амінокислот.Одне дослідження показало, що змішування амінокислоти з маззю полегшує опіки шкіри, а уражені ділянки повертаються до свого нормального стану, не перетворюючись на келоїдні рубці.
Амінокислоти також виявилися дуже корисними для догляду за пошкодженими кутикулами.Сухе безформне волосся може свідчити про зниження концентрації амінокислот в сильно пошкодженому роговому шарі.Амінокислоти мають здатність проникати в кутикулу волосяного стрижня і поглинати вологу з шкіри.Ця здатність поверхнево-активних речовин на основі амінокислот робить їх дуже корисними в шампунях, фарбах для волосся, пом’якшувачах для волосся, кондиціонерах для волосся, а наявність амінокислот робить волосся сильним.
11 Застосування в повсякденній косметиці
Зараз у всьому світі зростає попит на миючі засоби на основі амінокислот.Відомо, що AAS має кращу миючу здатність, піноутворення та властивості пом’якшення тканини, що робить їх придатними для побутових миючих засобів, шампунів, засобів для миття тіла та інших застосувань.Повідомляється, що амфотерна ААС, отримана з аспарагінової кислоти, є високоефективним миючим засобом із хелатними властивостями.Виявлено, що використання інгредієнтів миючого засобу, що складається з N-алкіл-β-аміноетоксикислот, зменшує подразнення шкіри.Повідомляється, що склад рідкого мийного засобу, що складається з N-кокоіл-β-амінопропіонату, є ефективним миючим засобом для видалення масляних плям на металевих поверхнях.Поверхнево-активна речовина на основі амінокарбонової кислоти C 14 CHOHCH 2 NHCH 2 COONa також має кращу мийну здатність і використовується для чищення текстилю, килимів, волосся, скла тощо. 2-гідрокси-3-амінопропіонова кислота-N,N- Відомо, що похідне ацетооцтової кислоти має хорошу комплексоутворювальну здатність і, таким чином, надає стабільність відбілюючим агентам.
Кейго та Тацуя повідомляють у своєму патенті про приготування миючих засобів на основі N-(N'-довголанцюгового ацил-β-аланіл)-β-аланіну для кращої пральної здатності та стабільності, легкого руйнування піни та хорошого пом’якшення тканини. .Компанія Kao розробила склад мийного засобу на основі N-ацил-1-N-гідрокси-β-аланіну та повідомила про слабке подразнення шкіри, високу водостійкість і високу ефективність видалення плям.
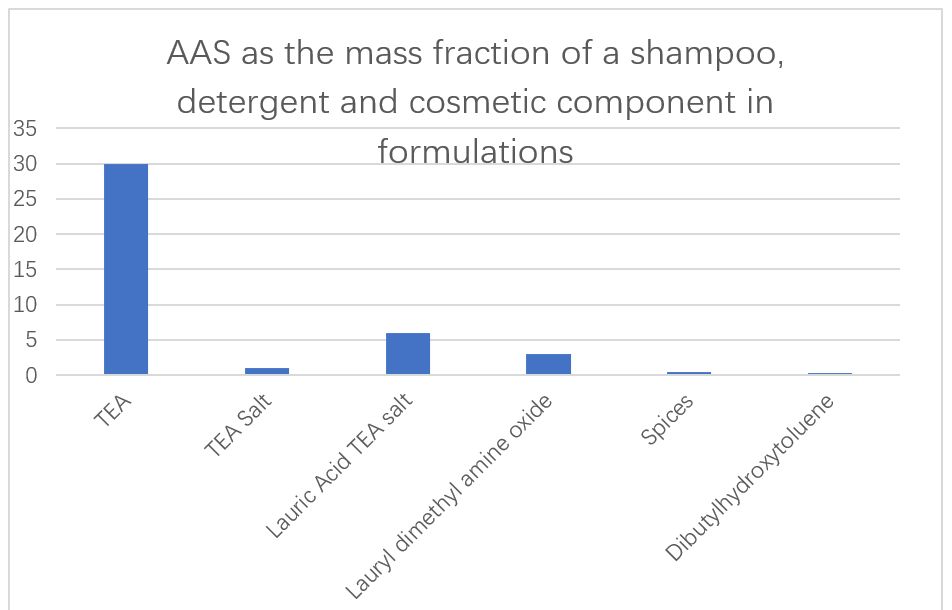
Японська компанія Ajinomoto використовує малотоксичні та легко розкладані ААС на основі L-глутамінової кислоти, L-аргініну та L-лізину як основні інгредієнти в шампунях, миючих засобах та косметиці (рис. 13).Також повідомляється про здатність ферментних добавок у складі мийних засобів видаляти білкове забруднення.Повідомлялося, що N-ацил-ААС, отримані з глутамінової кислоти, аланіну, метилгліцину, серину та аспарагінової кислоти, використовуються як чудові рідкі миючі засоби у водних розчинах.Ці поверхнево-активні речовини взагалі не підвищують в'язкість навіть при дуже низьких температурах і можуть бути легко перенесені з ємності для зберігання піноутворювача для отримання однорідної піни.
Час публікації: 09 червня 2022 р

